Autor: XIA Qiuying, SUN Shuo, ZAN Feng, XU Jing, XIA Hui
Escuela de Ciencia e Ingeniería de Materiales, Universidad de Ciencia y Tecnología de Nanjing, Nanjing 210094, China
Abstracto
Palabras clave: LiSiON; electrolito de película delgada; batería de litio totalmente sólida; batería de película delgada
El rápido desarrollo de la industria de la microelectrónica, como los sistemas microelectromecánicos (MEMS), microsensores, tarjetas inteligentes y microdispositivos médicos implantables, conduce a una demanda creciente de almacenamiento de energía integrado de tamaño micro[1,2]. Entre las tecnologías de baterías disponibles, la batería de litio de película delgada de estado sólido (TFLB) se considera la fuente de energía ideal para dispositivos microelectrónicos debido a su alta seguridad, tamaño pequeño, diseño de encendido en chip, ciclo de vida prolongado y bajo consumo. tasa de autodescarga. Como uno de los componentes clave del TFLB, el electrolito de película delgada de estado sólido desempeña un papel vital en la determinación de las propiedades del TFLB[3]. Por lo tanto, el desarrollo de electrolitos de película delgada de estado sólido de alto rendimiento es siempre un objetivo importante para el desarrollo de TFLB. En la actualidad, el electrolito más utilizado en TFLB es el oxinitruro de fósforo y litio amorfo (LiPON), que tiene una conductividad iónica moderada (2×10-6 S∙cm-1), una conductividad electrónica baja (~10-14 S∙cm-1 ), amplia ventana de voltaje (~5,5 V) y buena estabilidad de contacto con litio[4,5]. Sin embargo, su conductividad iónica es relativamente baja, lo que impide el desarrollo futuro de TFLB de alta potencia para la próxima era del Internet de las cosas (IoT)[6]. Por lo tanto, es urgente desarrollar nuevos electrolitos de película delgada con mayor conductividad iónica, así como una ventana de voltaje grande y buena estabilidad de contacto con el litio para TFLB de próxima generación.
Entre varios materiales de electrolitos inorgánicos en estado sólido, el sistema de solución sólida Li2O-SiO2 y sus fases deuterógenas se identificaron como posibles electrolitos de película delgada debido a sus rápidos canales de conducción de litio tridimensionales. Por ejemplo, Chen y otros [8] informaron que el electrolito sólido Li4.4Al0.4Si0.6O4-0.3Li2O sustituido con Al tiene una alta conductividad iónica de 5,4 × 10-3 S∙cm-1 a 200 ℃. Adnan y otros[9] encontró que el compuesto Li4Sn0.02Si0.98O4 posee un valor de conductividad máximo de 3.07×10-5 S∙cm-1 a temperatura ambiente. Sin embargo, los trabajos anteriores sobre sistemas de electrolitos Li2O-SiO2 se centraron principalmente en materiales en polvo con alta cristalinidad, mientras que se informó de trabajos muy limitados sobre sus homólogos de película fina amorfa para TFLB. Dado que el TFLB normalmente se construye depositando películas delgadas de cátodo, electrolito y ánodo capa por capa, es necesario preparar la película de electrolito a una temperatura relativamente baja para evitar las interacciones desfavorables entre el cátodo y el electrolito, que resultan en grietas y cortocircuitos de el TFLB[1,2]. Por lo tanto, desarrollar electrolitos Li2O-SiO2 con características amorfas preparados a baja temperatura es importante para TFLB. Aunque un trabajo reciente[6] muestra que se puede obtener una alta conductividad iónica de litio de 2,06×10-5 S∙cm-1 mediante una película delgada amorfa de Li-Si-PON, su estabilidad de contacto con los electrodos y su estabilidad electroquímica en TFLB aún no se han determinado. Para ser investigado. Por lo tanto, es de vital importancia desarrollar un electrolito de película delgada basado en Li2O-SiO2 de alto rendimiento y demostrar su aplicación real en TFLB.
En este trabajo, se preparó una película delgada de oxinitruro de silicio y litio amorfo (LiSiON) mediante pulverización catódica con magnetrón de radiofrecuencia (RF) a temperatura ambiente y se investigó como electrolito de estado sólido para TFLB. La potencia de pulverización y el flujo de gas de trabajo N2/Ar se optimizaron para obtener las mejores condiciones de deposición para la película delgada de LiSiON. Además, para demostrar la aplicabilidad del electrolito LiSiON optimizado para TFLB, se construyó una celda completa de MoO3/LiSiON/Li y se investigó sistemáticamente su rendimiento electroquímico.
1 experimental
1.1 Preparación de películas delgadas de LiSiON
Se prepararon películas delgadas de LiSiON mediante pulverización catódica con magnetrón RF (Kurt J. Lesker) utilizando un objetivo de Li2SiO3 (76,2 mm de diámetro) a temperatura ambiente durante 12 h. Antes de la deposición, la presión de la cámara se redujo a menos de 1 x 10-5 Pa. La distancia entre el objetivo y el sustrato fue de 10 cm. Las muestras depositadas bajo una potencia de RF de 80, 100 y 120 W con un flujo de 90 sccm N2 están marcadas como muestra LiSiON-80N9, LiSiON-100N9 y LiSiON-120N9, respectivamente. Y las muestras depositadas bajo una potencia de RF de 100 W con un flujo de 90 sccm N2 y 10 sccm Ar, 90 sccm N2 y 50 sccm Ar, 50 sccm N2 y 50 sccm Ar están marcadas como muestra LiSiON-100N9A1, LiSiON-100N9A5 y LiSiON-100N5A5, respectivamente.
La película de MoO3 se preparó mediante pulverización catódica reactiva con magnetrón de corriente continua (CC) (Kurt J. Lesker) utilizando un objetivo de Mo de metal puro (76,2 mm de diámetro) según nuestro informe anterior [10]. La distancia desde el objetivo al sustrato fue de 10 cm y la potencia de pulverización de CC fue de 60 W. La deposición se realizó a una temperatura del sustrato de 100 ℃ durante 4 h con un flujo de 40 sccm de Ar y 10 sccm de O2, seguido de un análisis in situ. Tratamiento de recocido a 450 ℃ durante 1 h. Luego se depositó LiSiON-100N9A1 sobre la película de MoO3 como electrolito. A continuación se depositó una película metálica de litio de aproximadamente 2 μm de espesor sobre la película de LiSiON mediante evaporación térmica al vacío (Kurt J. Lesker). El paso final de fabricación implicó la deposición del colector de corriente de Cu y el proceso de encapsulación.
Las estructuras cristalinas de las muestras se caracterizaron mediante difracción de rayos X (XRD, Bruker D8 Advance). Las morfologías y microestructuras de las muestras se caracterizaron mediante un microscopio electrónico de barrido por emisión de campo (FESEM, FEI Quanta 250F) equipado con espectroscopía de rayos X de energía dispersiva (EDS). Las composiciones elementales de las muestras se analizaron mediante espectrometría de masas con plasma acoplado inductivamente (ICP-MS, Agilent 7700X). La composición química y la información de enlace de las muestras se midieron mediante espectroscopía de fotoelectrones de rayos X (XPS, Escalab 250XI, Thermo Scientific).
1.4 Mediciones electroquímicas
La conductividad iónica del electrolito de película delgada LiSiON se midió utilizando una estructura intercalada de Pt/LiSiON/Pt. La espectroscopia de impedancia electroquímica (EIS) (de 1000 kHz a 0,1 Hz con una amplitud potencial de 5 mV) y las mediciones de voltamperometría cíclica (CV) de las muestras se llevaron a cabo en la estación de trabajo electroquímica Biologic VMP3. La medición de carga/descarga galvanostática (GCD) del MoO3/LiSiON/Li TFLB se llevó a cabo utilizando un sistema de batería Neware BTS4000 en una caja de guantes llena de argón a temperatura ambiente. Se utilizó una balanza analítica Sartorius (CPA225D, con resolución de 10 μg) para determinar la carga de masa del electrodo, y la carga de masa de la película de MoO3 es de aproximadamente 0,4 mg∙cm-2.
2 Resultados y discusión
Como se muestra en la imagen óptica insertada en la Fig. 1 (a), se empleó un objetivo de Li2SiO3 para preparar una película delgada de LiSiON. El resultado de XRD en la Fig. 1 (a) revela que el objetivo está compuesto por la fase principal de Li2SiO3 (JCPDS 83-1517) y la fase menor de SiO2. La medición ICP-MS indica que la relación atómica de Li: Si es aproximadamente 1,79: 1 en el objetivo. Se obtuvo una película delgada amorfa transparente para la muestra típica LiSiON-100N9A1 después de pulverizar el objetivo (Fig. 1 (b)). El espesor de la muestra típica LiSiON-100N9A1 medida a partir de la imagen FESEM de la sección transversal en la Fig. 1 (c) es de aproximadamente 1,2 μm, lo que indica una tasa de crecimiento de aproximadamente 100 nm∙h-1 en esta condición. Como se muestra en la imagen FESEM de vista superior en la Fig. 1 (d), la superficie de la película delgada de LiSiON es muy suave y densa sin grietas ni poros, lo que la convierte en un electrolito sólido adecuado para TFLB para evitar atajos y problemas de seguridad.
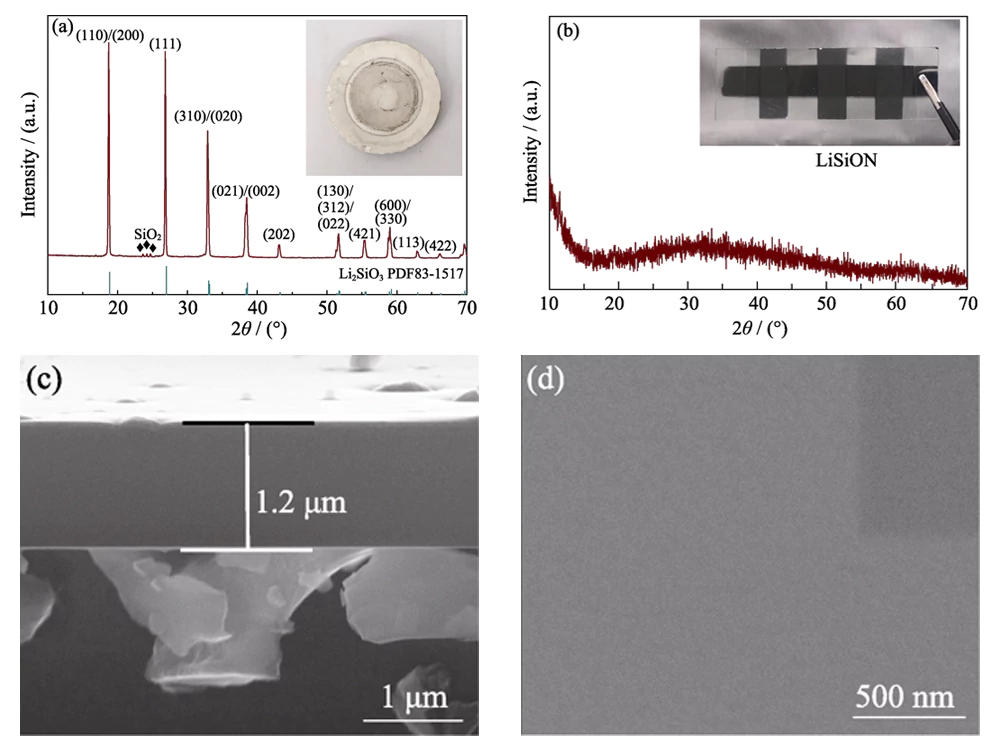
Fig. 1 (a) Patrón XRD e imagen óptica del objetivo Li2SiO3; (b) patrón XRD e imagen óptica de la muestra típica LiSiON-100N9A1; (c) Imágenes FESEM de sección transversal y (d) vista superior de la muestra típica LiSiON-100N9A1
Se llevó a cabo un análisis XPS para investigar la composición química y la información de enlace del objetivo Li2SiO3 y la muestra típica LiSiON-100N9A1. Los espectros de escaneo del estudio XPS en la Fig. 2 (a) revelan la presencia de elementos Li, Si y O en el objetivo Li2SiO3 y la introducción del elemento N en la película delgada de LiSiON. La relación atómica de N: Si en una película delgada de LiSiON es de aproximadamente 0,33: 1 según el resultado de XPS. Combinando con la relación atómica correspondiente (1,51: 1) obtenida mediante la medición ICP-MS, se determina que la estequiometría de la muestra típica LiSiON-100N9A1 es Li1,51SiO2,26N0,33. En comparación con el pico único de Si-Si (103,2 eV) en el espectro XPS a nivel central de Si2p del objetivo Li2SiO3 (Fig. 2(b)), se puede observar un pico adicional de Si-N (101,6 eV) en la película delgada de LiSiON. , lo que sugiere la aparición de nitruración en LiSiON [11,12]. El espectro XPS de nivel central de O1 del objetivo de Li2SiO3 en la Fig. 2 (c) muestra dos entornos de unión: 531,5 eV originados a partir de SiOx y 528,8 eV asignados a Li2O. Después de la deposición, se puede observar un componente adicional que emerge a 530,2 eV con una película delgada de LiSiON, que se puede asignar al oxígeno sin puente (On) en silicato [13,14]. El espectro XPS a nivel central de N1 de la película delgada de LiSiON en la Fig. 2 (d) se puede desconvolucionar en tres picos, incluidos 398,2 eV para el enlace Si-N, 396,4 eV para Li3N y 403,8 eV para especies de nitrito NO2-, lo que confirma aún más la incorporación de N a la red LiSiON[14,15,16]. Como se ilustra esquemáticamente en la Fig. 2 (e), la incorporación de N en la red LiSiON puede formar una estructura más reticulada, lo que es beneficioso para la conducción rápida de iones de litio [6,17].
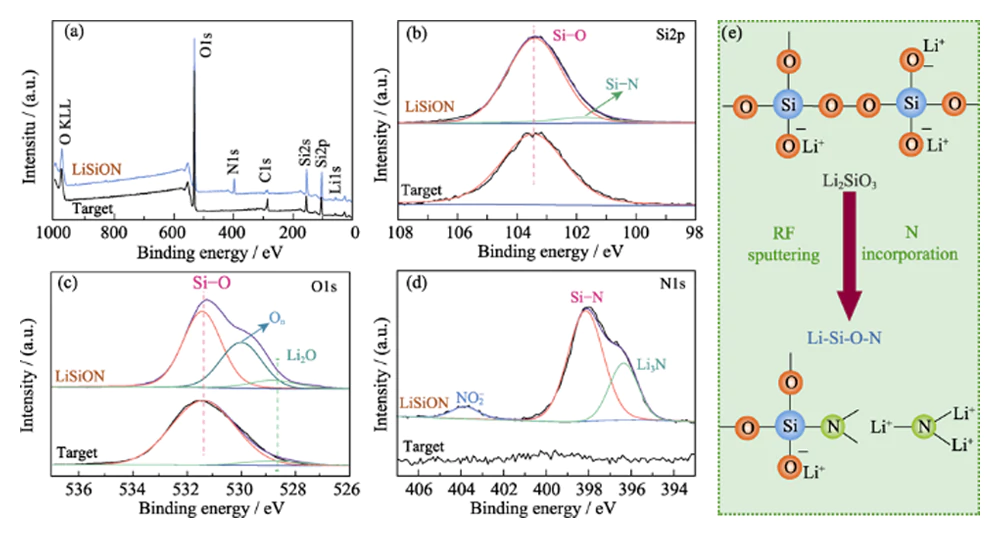
Fig. 2 (a) Escaneo de encuesta, (b) nivel de núcleo Si2p, (c) nivel de núcleo O1 y (d) espectros XPS a nivel de núcleo N1 del objetivo Li2SiO3 y la muestra típica LiSiON-100N9A1; (e) Ilustración esquemática del cambio de estructura parcial de Li2SiO3 a LiSiON con la incorporación de N
Para optimizar la conductividad iónica y la estabilidad electroquímica de las películas delgadas de LiSiON, se compararon varias películas delgadas de LiSiON con diferentes potencias de pulverización y flujos de gas de trabajo en términos de sus conductividades iónicas y ventanas de voltaje. Los diagramas de Nyquist a temperatura ambiente de las películas delgadas de LiSiON se representan en la Fig. 3 (a), y la estructura sándwich Pt / LiSiON / Pt correspondiente y el circuito equivalente se muestran en la Fig. 3 (b). Como se observó, los gráficos de Nyquist exhiben un semicírculo único y una cola de capacitancia dieléctrica, que es característico de un dieléctrico conductor de película delgada con un proceso de relajación en masa intercalado entre contactos de bloqueo [17]. Las conductividades iónicas (σi) de las películas delgadas de LiSiON se pueden calcular utilizando la ecuación. (1).
σi=d/(RA)
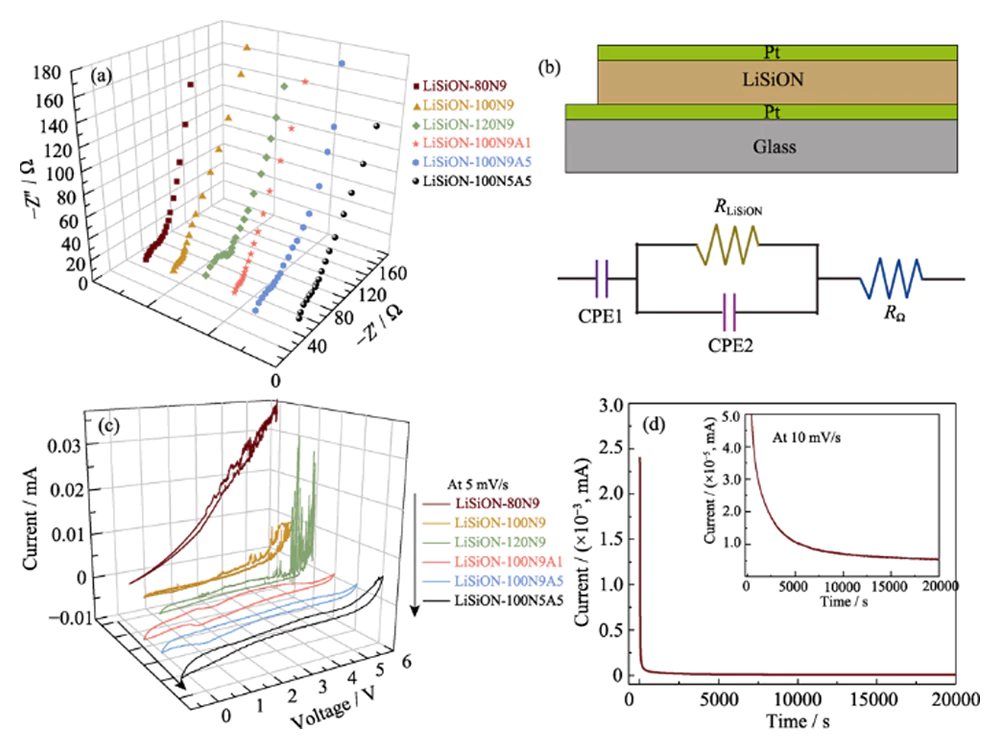
Fig. 3 (a) Espectros de espectroscopia de impedancia electroquímica (EIS) de las películas delgadas de LiSiON depositadas en diferentes condiciones; (b) Ilustración esquemática de la estructura sándwich Pt/LiSiON/Pt y el circuito equivalente correspondiente; (c) curvas CV de las películas delgadas de LiSiON depositadas en diferentes condiciones; (d) Curva de cronoamperometría de la muestra LiSiON-100N9A1
donde d es el espesor de la película, A es el área efectiva (aproximadamente 1 cm2) y R es la resistencia de la película estimada a partir del gráfico de Nyquist medido. Las conductividades iónicas calculadas para estas películas delgadas de LiSiON se comparan en la Tabla 1. Como se observa, la conductividad iónica de la película delgada de LiSiON depositada a un flujo constante de 90 sccm N2 aumenta con el aumento de la potencia de pulverización de 80 W a 100 W, luego disminuye cuando la potencia de pulverización se eleva aún más a 120 W, lo que es similar al informe anterior sobre el electrolito LiPON [18]. Se puede observar un aumento obvio en las conductividades iónicas cuando se promueve la proporción de N2 en el gas de trabajo bajo una potencia de pulverización constante de 100 W, lo que puede atribuirse a la mayor cantidad de nitrógeno incorporado en el LiSiON con un entorno más favorable para los iones de litio. movimiento[5, 18]. Cabe destacar que las muestras LiSiON-100N9 y LiSiON-100N9A1 muestran las conductividades iónicas más altas de 7,1×10-6 y 6,3×10-6 S∙cm-1, respectivamente, que son obviamente superiores a las del conocido LiPON (~2× 10-6 S∙cm-1), LiNbO3 amorfo previamente informado (~1×10-6 S∙cm-1)[19], LiBON (2,3×10-6 S∙cm-1)[20], Li- V-Si-O (~1×10-6 S∙cm-1)[21], Li-La-Zr-O (4×10-7 S∙cm-1)[22] y Li-Si- PO (1.6×10-6 S∙cm-1)[23] películas de electrolito, lo que revela que la película delgada amorfa de LiSiON es un candidato competitivo como electrolito para TFLB. La alta conductividad iónica de la película delgada de LiSiON se puede atribuir a la incorporación de N en la película delgada y a la formación de enlaces Si-N en lugar de enlaces Si-O, lo que lleva a una red aniónica más reticulada para la fácil movilidad de los iones de litio. 17, 24]. Las ventanas de voltaje electroquímico estable de las películas delgadas de LiSiON se evaluaron mediante medición de CV a una velocidad de escaneo de 5 mV∙s-1 con un voltaje de hasta 5,5 V. Cabe señalar que el impacto de las condiciones de deposición en la ventana de voltaje de LiSiON Las películas varían, lo que actualmente no puede explicarse mediante un mecanismo claro, ya que no hay investigaciones relevantes en informes anteriores sobre electrolitos de película delgada [18,24-25]. Sin embargo, en comparación con la Fig. 3(c) y la Tabla 1, las muestras LiSiON-100N9A1 y LiSiON-100N5A5 muestran las ventanas de voltaje más amplias de ~5,0 y ~5,2 V, respectivamente, que están cerca de las del electrolito LiPON. Por lo tanto, teniendo en cuenta tanto la conductividad iónica como la ventana de voltaje, se eligió la muestra LiSiON-100N9A1 para una mayor investigación y la fabricación de la celda completa. Para explorar el número de transferencia de iones de litio (τi) y la conductividad electrónica (σe) de la muestra LiSiON-100N9A1, se realizó una cronoamperometría a un voltaje constante de 10 mV (Fig. 3 (d)). El τi se puede calcular mediante la ecuación. (2).
τi=(Ib-Ie)/Ib
donde Ib es la corriente de polarización inicial e Ie es la corriente de estado estable [18]. Se calculó que τi era 0,998, que está cerca de 1, lo que indica que la conducción de iones de litio es absolutamente dominante en el electrolito. El τi está determinado por un efecto mixto de la conducción de iones y electrones[24], que puede expresarse mediante la ecuación. (3).
τi=σi/(σi+σe)
Por lo tanto, se calcula que el σe de la muestra LiSiON-100N9A1 es 1,26 × 10-8 S∙cm-1, que es insignificante en comparación con su conductividad iónica.
Tabla 1 Comparación de conductividades de iones de litio y ventanas de voltaje de películas delgadas de LiSiON depositadas en diferentes condiciones
Muestra |
Conductividades de iones de litio |
Ventanas de voltaje |
LiSiON-80N9 |
4.6 |
~2.0 |
LiSiON-100N9 |
7.1 |
~3.9 |
LiSiON-120N9 |
2.5 |
~4.2 |
LiSiON-100N9A1 |
6.3 |
~5.0 |
LiSiON-100N9A5 |
3.0 |
~4.6 |
LiSiON-100N5A5 |
2.9 |
~5.2 |
Para verificar la viabilidad de la muestra optimizada LiSiON-100N9A1 para la aplicación TFLB, se fabricó adicionalmente MoO3/LiSiON/Li TFLB. La imagen FESEM de sección transversal y las imágenes de mapeo EDS correspondientes del MoO3 / LiSiON / Li TFLB se muestran en la Fig. 4 (a). Como se observa, el cátodo de MoO3 (aproximadamente 1,1 μm de espesor) y el ánodo de Li están bien separados por el electrolito LiSiON, y el electrolito LiSiON tiene interfaces de contacto estrechas tanto con el cátodo como con el ánodo. La Fig. 4(b) muestra la curva CV típica del TFLB a una velocidad de escaneo de 0,1 mV∙s-1 entre 1,5-3,5 V, que muestra un par de picos redox bien definidos en alrededor de 2,25 y 2,65 V, correspondientes a inserción y extracción de iones de litio del MoO3 [10]. La figura 4 (c) muestra las 3 curvas iniciales de carga/descarga galvanostática del TFLB a una densidad de corriente de 50 mA∙g-1 (20 μA∙cm-2, basado en la masa de la película de MoO3). Como se observó, el TFLB ofrece capacidades de carga/descarga iniciales de 145/297 mAh∙g-1 (58/118,8 μAh∙cm-2). Después del segundo ciclo, el TFLB logró un comportamiento de ciclado estable con una alta capacidad específica reversible de 282 mAh∙g-1. El rendimiento de la tasa del TFLB a varias densidades de corriente se muestra en la Fig. 4 (d). La pérdida de capacidad irreversible del TFLB en varios ciclos iniciales a baja densidad de corriente puede atribuirse a una transición de fase irreversible en el MoO3 derivada de la inserción de litio [26]. Se observan capacidades de descarga estables de aproximadamente 219, 173, 107 y 50 mAh∙g-1 a 100, 200, 400 y 800 mA∙g-1, respectivamente, lo que demuestra una buena capacidad de velocidad. Para evaluar la estabilidad electroquímica del TFLB, el rendimiento del ciclo se realizó además con una densidad de corriente de 200 mA∙g-1 (Fig. 4(e)). El TFLB puede retener el 78,1% de su capacidad de descarga inicial después de 200 ciclos, y la eficiencia de Coulombic es cercana al 100% para cada ciclo, lo que revela una estabilidad electroquímica aceptable del electrolito LiSiON. Las mediciones de EIS se llevaron a cabo a voltaje de circuito abierto para investigar la interfaz electrolito/electrodo en el TFLB en diferentes números de ciclo, y los diagramas de Nyquist correspondientes con circuito equivalente se representan en la Fig. 4 (f). Como se observa, el TFLB MoO3/LiSiON/Li muestra un espectro EIS similar, que consta de dos semicírculos en la región de alta frecuencia en estado fresco, al del TFLB MoO3/LiPON/Li en nuestro trabajo anterior[10], lo que indica que el TFLB Li/ La resistencia de la interfaz LiSiON es insignificante en comparación con la de la interfaz LiSiON/MoO3[20]. El primer semicírculo pequeño en los gráficos de Nyquist se atribuye a la conducción iónica de iones Li+ en el electrolito LiSiON, mientras que el segundo semicírculo grande corresponde al proceso de transferencia de carga en la interfaz LiSiON/MoO3 [27,28]. Se observa que el primer semicírculo pequeño rara vez cambia durante los ciclos, lo que indica la estabilidad cíclica relativamente buena del electrolito LiSiON. Sin embargo, el segundo semicírculo se expande gradualmente a medida que evoluciona el número del ciclo, revelando el aumento de la resistencia interfacial LiSiON/MoO3 durante el ciclismo, lo que podría ser la razón principal del desvanecimiento de la capacidad del TFLB [29]. Vale la pena mencionar que este trabajo adopta con éxito el electrolito LiSiON para construir TFLB y demuestra por primera vez el buen contacto interfacial de LiSiON tanto con el cátodo de MoO3 como con el ánodo de litio. Además, la gran capacidad específica, la buena capacidad de velocidad y el rendimiento del ciclo aceptable del MoO3/LiSiON/Li TFLB demuestran que la película delgada de LiSiON es bien aplicable como electrolito para TFLB.
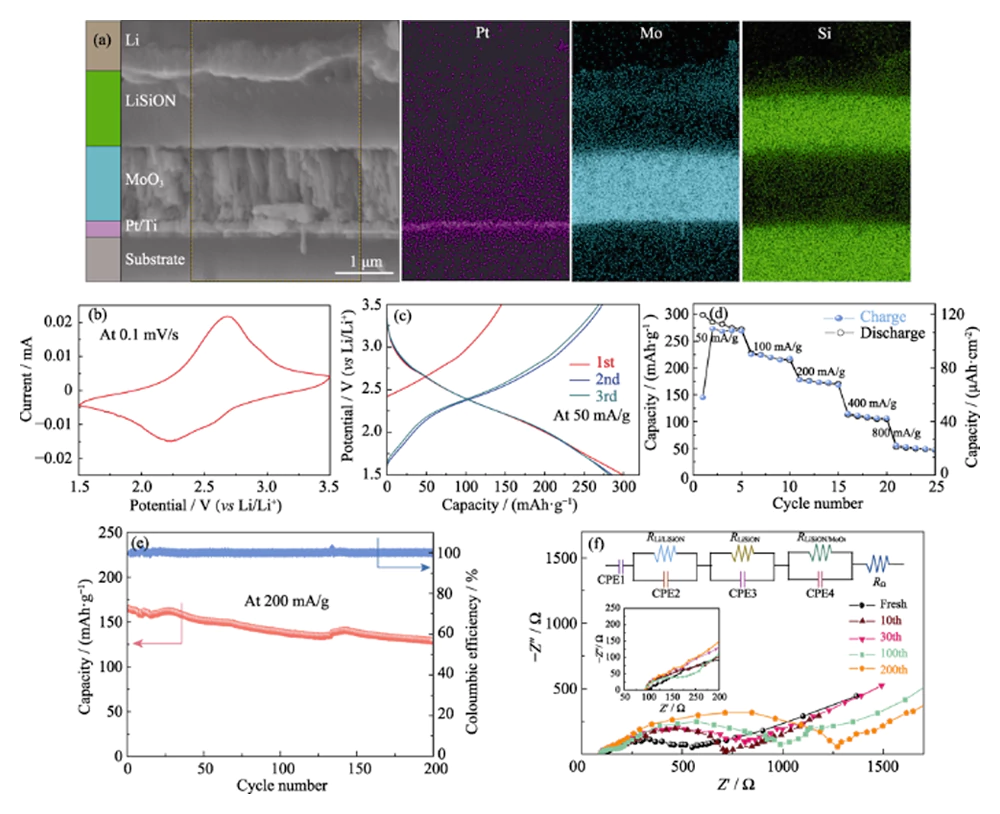
Fig. 4 (a) Imagen FESEM de sección transversal e imágenes de mapeo EDS correspondientes del MoO3/LiSiON/Li TFLB; (b) Curva CV típica, (c) tres curvas iniciales de carga/descarga, (d) rendimiento de velocidad, (e) rendimiento del ciclo y (f) espectros EIS en diferentes números de ciclo del MoO3/LiSiON/Li TFLB con muestra de LiSiON -100N9A1 como electrolito
3 Conclusiones
En resumen, se preparó con éxito un electrolito de película delgada de LiSiON amorfo mediante pulverización catódica con magnetrón de RF utilizando un objetivo de Li2SiO3 con flujo de gas N2/Ar. La película delgada optimizada de LiSiON depositada bajo una potencia de RF de 100 W con un flujo de 90 sccm N2 y 10 sccm Ar posee una superficie lisa, una estructura densa, una alta conductividad iónica (6,3 × 10-6 S∙cm-1) y una amplia ventana de voltaje. (5 V), lo que lo convierte en un material electrolítico prometedor para TFLB. Más importante aún, al utilizar el electrolito LiSiON, se demostró con éxito por primera vez un TFLB MoO3/LiSiON/Li con alta capacidad específica (282 mAh∙g-1 a 50 mA∙g-1), buen rendimiento de velocidad (50 mAh∙ g-1 a 800 mA∙g-1) y estabilidad de ciclo aceptable (78,1% de retención de capacidad después de 200 ciclos). Se espera que este trabajo brinde nuevas oportunidades para desarrollar TFLB de alto rendimiento mediante el uso de electrolitos de película delgada a base de Li2O-SiO2.
Referencias
[1] MOITZHEIM S, PUT B, VEREECKEN P M. Avances en baterías de iones de litio de película delgada 3D. Interfaces de materiales avanzados, 2019,6(15):1900805.
[2] XIA Q, ZHANG Q, SUN S, et al. Matrices de nanohojas de LixMnO2 de crecimiento intercalado en túneles como cátodos 3D para microbaterías de litio de película delgada de estado sólido y alto rendimiento. Materiales avanzados, 2021,33(5):2003524.
[3] DENG Y, EAMES C, FLEUTOT B, et al. Mejora de la conductividad de los iones de litio en electrolitos sólidos del conductor superiónico de litio (LISICON) mediante un efecto de polianión mixto. Interfaces y materiales aplicados ACS, 2017,9(8):7050-7058.
[4] BATES JB, DUDNEY NJ, GRUZALSKI GR, et al. Fabricación y caracterización de películas delgadas de electrolitos de litio amorfos y baterías recargables de película delgada. Revista de fuentes de energía, 1993, 43 (1/2/3): 103-110.
[5] BATES J. Propiedades eléctricas de películas delgadas de electrolito de litio amorfo. Iónicos de estado sólido, 1992, 53 (56): 647-654.
[6] FAMPRIKIS T, GALIPAUD J, CLEMENS O, et al. Dependencia de la composición de la conductividad iónica en electrolitos de película delgada LiSiPO (N) para baterías de estado sólido. Materiales energéticos aplicados ACS, 2019,2(7):4782-4791.
[7] DENG Y, EAMES C, CHOTARD JN, et al. Conocimientos estructurales y mecanicistas sobre la conducción rápida de iones de litio en electrolitos sólidos Li4SiO4-Li3PO4. Revista de la Sociedad Química Estadounidense, 2015,137(28):9136-9145.
[8] CHEN R, SONG X. La conductividad iónica de electrolitos sólidos para sistemas Li4 + xMxSi1-xO4-yLi2O (M = Al, B). Revista de la Sociedad Química China, 2002,49:7-10.
[9] ADNAN S, MOHAMED N S. Efectos de la sustitución de Sn en las propiedades del electrolito cerámico Li4SiO4. Iónicos de estado sólido, 2014,262:559-562.
[10] SUN S, XIA Q, LIU J, et al. Matrices autónomas de nanohojuelas de α-MoO3-x con deficiencia de oxígeno como cátodos 3D para baterías avanzadas de litio de película delgada totalmente de estado sólido. Revista de Materiomics, 2019,5(2):229-236.
[11] DING W, LU W, DENG X, et al. Un estudio XPS sobre la estructura de la película SiNx depositada mediante pulverización catódica con magnetrón ECR de microondas. Acta Physica Sínica, 2009, 58(6):4109-4116.
[12] KIM H, KIM Y. Nitruración parcial de Li4SiO4 y conductividad iónica de Li4. 1SiO3. 9N0. 1Cerámica Internacional, 2018,44(8):9058-9062.
[13] MARIKO M, HIDEMASA K, TOMOYUKI O, et al. Análisis de ánodos de SiO para baterías de iones de litio. Revista de la Sociedad Electroquímica, 2005,152(10):A2089.
[14] FINGERLE M, BUCHHEIT R, SICOLO S, et al. Formación de capas de carga espacial y de reacción en la interfaz LiCoO2-LiPON: conocimientos sobre la formación de defectos y la alineación del nivel de energía iónica mediante un enfoque combinado de simulación científica de superficies. Materiales químicos, 2017,29(18):7675-7685.
[15] OESTE W, HOOD Z, ADHIKARI S, et al. Reducción de la resistencia a la transferencia de carga en la interfaz electrolito sólido-electrodo mediante deposición con láser pulsado de películas de una fuente cristalina de Li2PO2N. Revista de fuentes de energía, 2016,312:116-122.
[16] SICOLO S, FINGERLE M, HAUSBRAND R, et al. Inestabilidad interfacial de LiPON amorfo contra litio: una teoría funcional de densidad combinada y un estudio espectroscópico. Revista de fuentes de energía, 2017,354:124-133.
[17] WUF, LIU Y, CHEN R, et al. Preparación y rendimiento de un novedoso electrolito de película delgada Li-Ti-Si-PON para baterías de litio de película delgada. Revista de fuentes de energía, 2009,189(1):467-470.
[18] PUT B, VEREECKEN M, MEERSSCHAUT J, et al. Caracterización eléctrica de capas ultrafinas de LiPON pulverizadas por RF para baterías a nanoescala. Interfaces y materiales aplicados ACS, 2016,8(11):7060-7069.
[19] NIINOMI H, MOTOYAMA M, IRIYAMA Y. Conducción de Li+ en películas de Li-Nb-O depositadas mediante un método Sol-Gel. Iónicos de estado sólido, 2016, 285:13-18.
[20] SONG S, LEE K, PARK H. Microbaterías flexibles de estado sólido de alto rendimiento basadas en electrolito sólido de oxinitruro de boro y litio. Revista de fuentes de energía, 2016,328:311-317.
[21] OHTSUKA H, OKADA S, YAMAKI J. Batería de estado sólido con película delgada de electrolito sólido Li2O-V2O5-SiO2. Iónicos de estado sólido, 1990, 40-41:964-966.
[22] Kalita D, Lee S, Lee K, et al. Propiedades de conductividad iónica del electrolito sólido amorfo Li-La-Zr-O para baterías de película delgada. Iónicos de estado sólido, 2012,229:14-19.
[23] SAKURAI Y, SAKUDA A, HAYASHI A, et al. Preparación de películas delgadas amorfas de Li4SiO4-Li3PO4 mediante deposición con láser pulsado para baterías secundarias de litio en estado sólido. Iónicos de estado sólido, 2011, 182:59-63.
[24] TAN G, WUF, LI L, et al. Preparación por pulverización catódica con magnetrón de electrolitos de película delgada a base de fosfato de litio, aluminio y titanio incorporados con nitrógeno para baterías de iones de litio de estado sólido. La Revista de Química Física C, 2012,116(5):3817-3826.
[25] YU X, BATES JB, JELLISON G, et al. Un electrolito de litio de película delgada estable: oxinitruro de fósforo y litio. Revista de la Sociedad Electroquímica, 1997, 144(2):524.
[26] KIM H, COOK J, LIN H, et al. Las vacantes de oxígeno mejoran las propiedades de almacenamiento de carga pseudocapacitiva del MoO3-x. Materiales de la naturaleza, 2017,16:454-460.
[27] CANCIÓN H, WANG S, CANCIÓN X, et al. Baterías de litio-aire de estado sólido totalmente impulsadas por energía solar que funcionan a temperaturas extremadamente bajas. Energía y ciencias ambientales, 2020,13(4):1205-1211.
[28] WANG Z, LEE J, XIN H, et al. Efectos de la capa interfacial de electrolito catódico (CEI) en el ciclo a largo plazo de baterías de película delgada de estado sólido. Revista de fuentes de energía, 2016,324:342-348.
[29] QIAO Y, DENG H, HE P, et al. Una celda de litio-metal de 500 Wh/kg basada en redox aniónico. Joule, 2020,4(6):1311-1323.