Marco de carbono hueco dopado con cobalto como huésped de azufre para el cátodo de la batería de azufre de litio
Autor: JIN Gaoyao, HE Haichuan, WU Jie, ZHANG Mengyuan, LI Yajuan, LIU Younian. Marco de carbono hueco dopado con cobalto como huésped de azufre para el cátodo de la batería de azufre de litio. Revista de materiales inorgánicos[J], 2021, 36(2): 203-209 DOI:10.15541/jim20200161
TOB New Energy proporciona varios materiales de batería para batería de iones de litio, batería de iones de sodio, batería de azufre de litio, batería de estado sólido, celda , etc. Contáctenos para cotización.
Aunque el rendimiento del cátodo se puede mejorar hasta cierto punto con la sinergia de los heteroátomos y el marco de carbono, todavía está significativamente limitado por la cinética lenta de la reacción de conversión de polisulfuro, que provoca la acumulación excesiva de LiPS y la difusión inevitable. Los compuestos de metales de transición se han introducido ampliamente en el huésped de azufre para acelerar la cinética de la reacción de conversión. En los últimos años, nanopartículas de metales específicos, como Co, Fe y Pt, mostraron un efecto acelerador similar. Entre estos metales, el metal cobalto ha atraído la atención de los investigadores por su excelente conductividad y su fuerte interacción con los polisulfuros. Durante el proceso de carga y descarga, puede capturar de manera efectiva los polisulfuros y promover la reacción de conversión. Li, et al. obtuvo el carbono dopado con Co y N como huésped de azufre mediante la calcinación del precursor ZIF-67. Las nanopartículas de Co dispersadas uniformemente aceleraron claramente la reacción redox con el efecto sinérgico de los grupos dopados con N. Además, Du, et al. presentó el cátodo de grafeno dopado con nitrógeno incrustado con átomos de cobalto monodispersos, y Wu, et al. fabricaron nanopuntos de Co/carbono mesoporoso dopado con N con la calcinación in situ de adenina y CoCl2. En todos estos informes, los sistemas con contenido de Co obtuvieron excelentes rendimientos de ciclo. nanodots Co fabricados/carbono mesoporoso dopado con N con la calcinación in situ de adenina y CoCl2. En todos estos informes, los sistemas con contenido de Co obtuvieron excelentes rendimientos de ciclo. nanodots Co fabricados/carbono mesoporoso dopado con N con la calcinación in situ de adenina y CoCl2. En todos estos informes, los sistemas con contenido de Co obtuvieron excelentes rendimientos de ciclo.
En este trabajo, para mejorar el rendimiento cíclico y de velocidad de las baterías de Li-S, se diseñó un marco de carbono hueco 3D decorado con nanopartículas de cobalto como anfitrión del cátodo de azufre. El citrato de sodio, un aditivo barato y abundante, se emplea como fuente de carbono por su carácter único durante la calcinación directa. Y el rendimiento electroquímico del sistema que contiene cobalto (Co/C-700) y el marco de carbono (HEC-700) se evaluó sistemáticamente para garantizar el efecto de las nanopartículas de cobalto dopadas para el cátodo de azufre.
1 experimental
1.1 Síntesis de materiales
Todos los reactivos químicos utilizados en este trabajo fueron de grado analítico sin purificación adicional. Brevemente, se disolvieron 0,25 g de Co(NO3)2·6H2O y 5,0 g de citrato de sodio en 20 ml de agua desionizada con agitación magnética para formar una solución homogénea. Luego, la solución se liofilizó, se molió en polvo fino y se calcinó a 700 ℃ bajo N2 durante 1 h con una velocidad de calentamiento de 5 ℃∙min-1. Los compuestos obtenidos (denominados UWC-700) se lavaron con agua desionizada 3 veces para eliminar los subproductos. Después de secarse a 60 ℃ durante la noche, el producto final se recogió y se denominó Co/C-700. Para confirmar aún más el efecto del Co, se obtuvo carbón grabado con ácido clorhídrico (HEC-700) grabando Co/C-700 en HCl 2 mol/L durante 12 h, lavando hasta neutralidad y secando a 80 ℃ durante 12 h.
Los compuestos de cátodo se prepararon mediante un método convencional de fusión-difusión. En resumen, se molió una mezcla de compuestos de azufre (70% en peso) y Co/C-700 (o HEC-700) durante 20 min, se transfirió a un autoclave de recipiente de teflón de 20 ml y se calentó a 155 ℃ durante 12 h. El polvo obtenido se recogió como S@Co/C-700 y S@HEC-700. La caracterización de materiales y la adsorción estática de polisulfuros se muestran en los materiales de apoyo.
1.2 Caracterización electroquímica
El rendimiento electroquímico de los cátodos S@Co/C-700 y S@HEC-700 se probó con celdas tipo moneda CR2025, fabricadas en una guantera llena de argón (MBraun, Alemania). La suspensión de cátodo de azufre se preparó mezclando S@Co/C-700 (o S@HEC-700), negro de acetileno y aglutinante de difluoruro de polivinilideno (PVDF) con una proporción de peso de 7:2:1 en N-metil-2- pirrolidinona (NMP). Luego, la suspensión obtenida se vertió uniformemente sobre una lámina de aluminio. Además, la membrana se secó a 50 ℃ al vacío durante la noche y se cortó en discos (1 cm de diámetro) con una carga de azufre de 1,1-1,7 mg∙cm-2. Se usó la membrana de polipropileno de rutina (Celgard 2400) para separar el cátodo y el ánodo de litio. El electrolito utilizado en cada celda fue 50 μL 1mol/L LiN(CF3SO2)2 y una solución de LiNO3 al 1% en peso en DOL/DME (1:1 en volumen). Las pruebas galvanostáticas de carga y descarga se realizaron con un sistema de prueba de batería LAND CT 2001A (Jinnuo Electronic Co, Wuhan, China) dentro de la ventana de voltaje de 1,7-2,8 V. La medición de voltametría cíclica (CV) se realizó de 1,5 a 3,0 V a una tasa de exploración de 0,1 mV∙s-1. La espectroscopia de impedancia electroquímica (EIS) se llevó a cabo en el rango de frecuencia de 0,1 MHz a 10 mHz con una amplitud de voltaje de 5 mV en circuito abierto. Las mediciones de CV y EIS se llevaron a cabo en una estación de trabajo electroquímica CHI 660E (Chenhua Instruments Co, Shanghái, China). Las celdas simétricas se ensamblaron con Co/C-700 o HEC-700 (8:2 con PVDF en relación de peso) como cátodo y ánodo idénticos, y 50 μL de electrolito de 1 mol/L LiN(CF3SO2)2, 1% en peso de LiNO3 y 0,2 mol/L Li2S6 en solución DOL/DME (1:1 en volumen). China) dentro de la ventana de voltaje de 1,7-2,8 V. La medición de voltamperometría cíclica (CV) se realizó de 1,5 a 3,0 V a una velocidad de exploración de 0,1 mV∙s-1. La espectroscopia de impedancia electroquímica (EIS) se llevó a cabo en el rango de frecuencia de 0,1 MHz a 10 mHz con una amplitud de voltaje de 5 mV en circuito abierto. Las mediciones de CV y EIS se llevaron a cabo en una estación de trabajo electroquímica CHI 660E (Chenhua Instruments Co, Shanghái, China). Las celdas simétricas se ensamblaron con Co/C-700 o HEC-700 (8:2 con PVDF en relación de peso) como cátodo y ánodo idénticos, y 50 μL de electrolito de 1 mol/L LiN(CF3SO2)2, 1% en peso de LiNO3 y 0,2 mol/L Li2S6 en solución DOL/DME (1:1 en volumen). China) dentro de la ventana de voltaje de 1,7-2,8 V. La medición de voltamperometría cíclica (CV) se realizó de 1,5 a 3,0 V a una velocidad de exploración de 0,1 mV∙s-1. La espectroscopia de impedancia electroquímica (EIS) se llevó a cabo en el rango de frecuencia de 0,1 MHz a 10 mHz con una amplitud de voltaje de 5 mV en circuito abierto. Las mediciones de CV y EIS se llevaron a cabo en una estación de trabajo electroquímica CHI 660E (Chenhua Instruments Co, Shanghái, China). Las celdas simétricas se ensamblaron con Co/C-700 o HEC-700 (8:2 con PVDF en relación de peso) como cátodo y ánodo idénticos, y 50 μL de electrolito de 1 mol/L LiN(CF3SO2)2, 1% en peso de LiNO3 y 0,2 mol/L Li2S6 en solución DOL/DME (1:1 en volumen). La espectroscopia de impedancia electroquímica (EIS) se llevó a cabo en el rango de frecuencia de 0,1 MHz a 10 mHz con una amplitud de voltaje de 5 mV en circuito abierto. Las mediciones de CV y EIS se llevaron a cabo en una estación de trabajo electroquímica CHI 660E (Chenhua Instruments Co, Shanghái, China). Las celdas simétricas se ensamblaron con Co/C-700 o HEC-700 (8:2 con PVDF en relación de peso) como cátodo y ánodo idénticos, y 50 μL de electrolito de 1 mol/L LiN(CF3SO2)2, 1% en peso de LiNO3 y 0,2 mol/L Li2S6 en solución DOL/DME (1:1 en volumen). La espectroscopia de impedancia electroquímica (EIS) se llevó a cabo en el rango de frecuencia de 0,1 MHz a 10 mHz con una amplitud de voltaje de 5 mV en circuito abierto. Las mediciones de CV y EIS se llevaron a cabo en una estación de trabajo electroquímica CHI 660E (Chenhua Instruments Co, Shanghái, China). Las celdas simétricas se ensamblaron con Co/C-700 o HEC-700 (8:2 con PVDF en relación de peso) como cátodo y ánodo idénticos, y 50 μL de electrolito de 1 mol/L LiN(CF3SO2)2, 1% en peso de LiNO3 y 0,2 mol/L Li2S6 en solución DOL/DME (1:1 en volumen).
2 Resultados y discusión
La figura 1 muestra la ilustración esquemática del procedimiento sintético para un compuesto de carbono dopado con cobalto tridimensional (3D). Cuando el citrato de sodio (SC) se recoció en una atmósfera inerte, las especies de Na+ se transformaron en cristales de Na2CO3 mientras que en la superficie aparecían nanoláminas de carbono ultrafinas. Con el aumento adicional de la temperatura, los cristales actúan como agente activador y reaccionan con el carbón revestido para formar capas porosas estratificadas. Mientras tanto, los elementos de cobalto se transformaron en nanopartículas de Co y se incrustaron en una estructura de carbono con la reducción térmica de carbono.
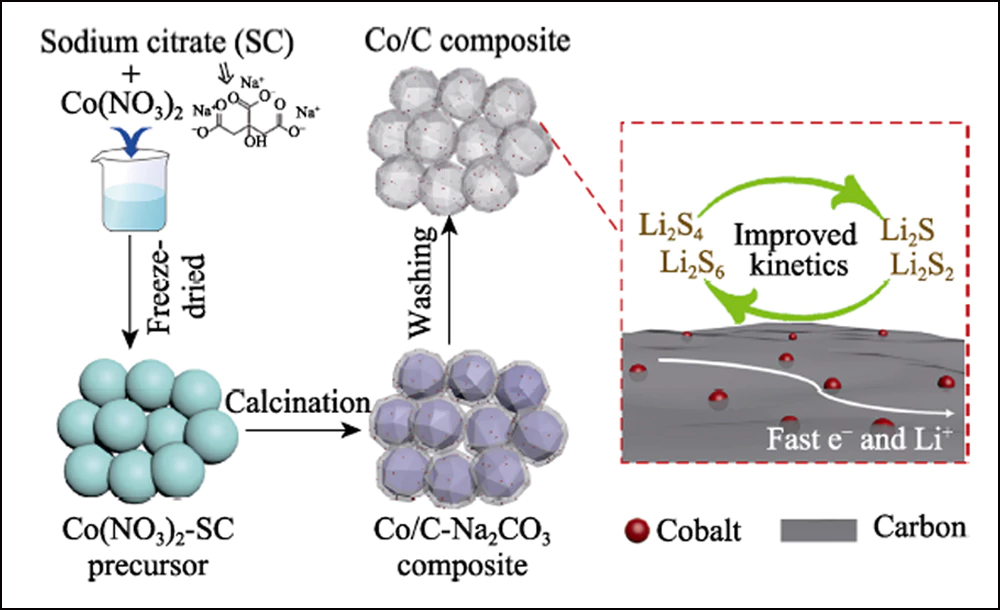
Fig. 1 Ilustración esquemática de los pasos de síntesis del compuesto Co/C hueco y su efecto en el electrodo resultante
La composición y estructura cristalina de UWC-700 y Co/C-700 se caracterizaron por XRD. Los principales picos de difracción de UWC-700 (Fig. S1) son consistentes con el Na2CO3 monoclínico (PDF#72-0628), mientras que otros tres picos en 2θ=44.2°, 51.5° y 75.9° encajan bien con los datos cristalinos de Co (PDF #15-0806), que indica la descomposición total de SC y la reducción del elemento cobalto. El patrón XRD de Co/C-700 (Fig. 2(a)) con solo picos característicos de cobalto metálico sugiere la eliminación completa de Na2CO3. Además, el pico ancho obvio alrededor de 2θ=26° representa el plano (002) del carbono grafitado. Mientras tanto, como se muestra en los espectros Raman (Fig. 2(b)) de Co/C-700, la relación de intensidad para las dos bandas obvias de D (1382 cm-1) y G (1594 cm-1) es 0.866, respondiendo a su alto grado grafitado. Además, el pico pequeño a 680 cm-1 es el pico característico del cobalto. La curva TGA de Co/C-700 se muestra en la Fig. S2(a) para garantizar el contenido de Co. El producto final (17,83% en peso) después de la prueba TGA se puede identificar como Co3O4 (Fig. S2(b)), y el contenido de Co correspondiente en Co/C-700 es 13,09% en peso por cálculo, lo que encaja bien con el resultado XPS (Fig. 2 (c)), las relaciones atómicas y de peso de Co son 3.24% en peso y 13.66% en peso, respectivamente.
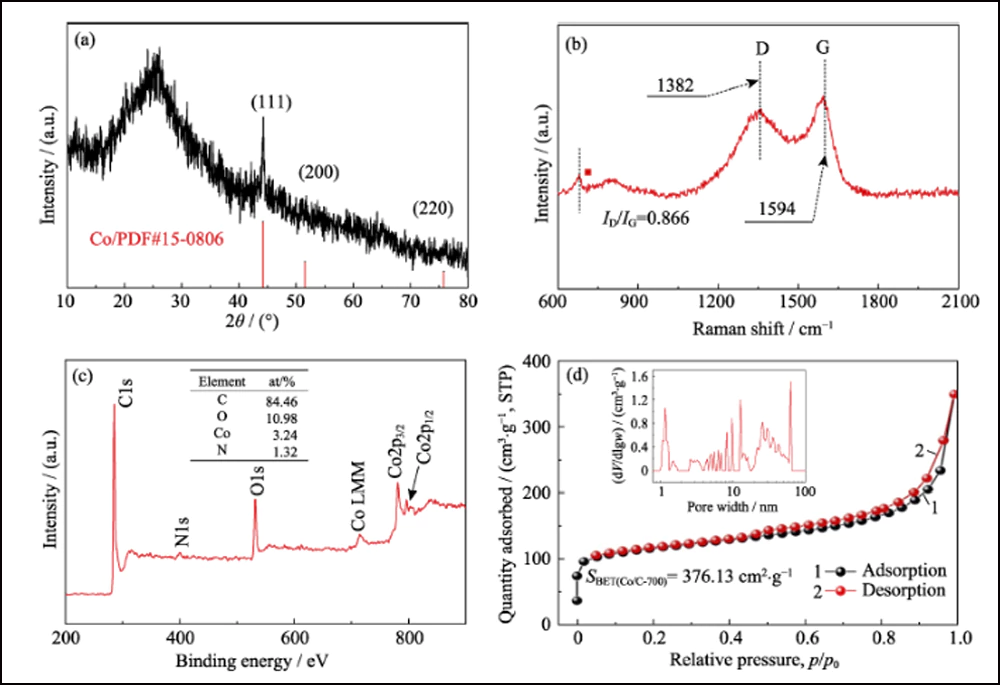
Fig. 2 (a) patrón XRD, (b) espectro Raman, (c) espectro XPS y (d) isoterma de adsorción/desorción de N2 de Co/C-700 con inserto en (d) que muestra la distribución del tamaño de poro
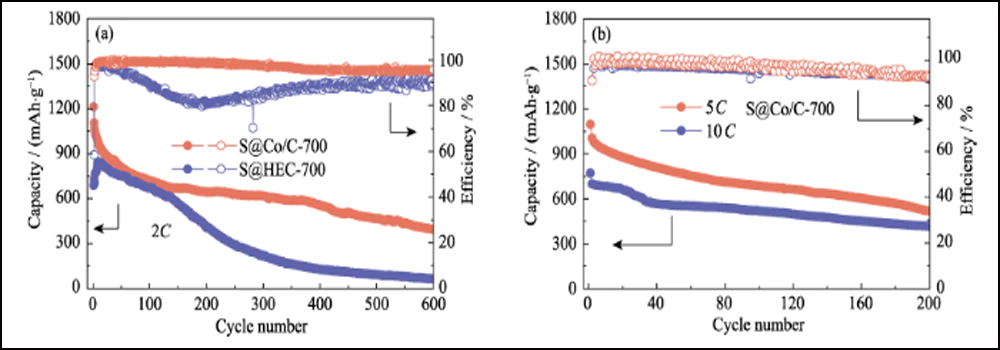
Fig. S1 Patrón XRD de UWC-700
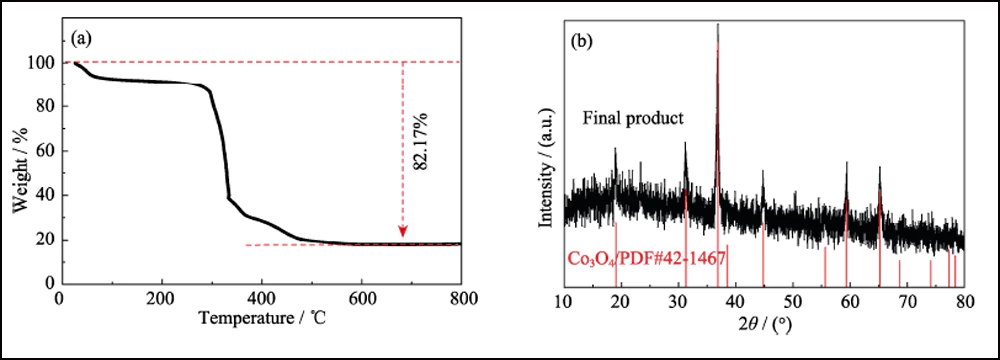
Fig. S2 (a) curva TGA de Co/C-700 en aire y (b) patrón XRD del producto final
La estructura porosa de Co/C se caracterizó por métodos BET. La isoterma de adsorción-desorción de N2 (Fig. 2 (d)) muestra un ciclo de histéresis distinto, que representa la estructura mesoporosa abundante. El valor del área de superficie específica y el volumen de poro se midieron en 376,13 m2∙g-1 y 0,52 cm3∙g-1, respectivamente. La distribución del tamaño de poro (recuadro en la Fig. 2 (d)) determinada por el método Barrett-Joyner-Halenda (BJH) muestra una estructura porosa jerárquicamente distinta con alta mesoporosidad (62.76%, Tabla S1). El mesoporo interconectado y la alta área de superficie pueden exponer adecuadamente los sitios de cobalto para la adsorción y una mayor mejora de la reacción redox. Además, se realizaron las mismas pruebas con las otras dos muestras, UWC-700 y HEC-700 (Fig. S3). El área superficial extremadamente baja (15,09 m2∙g-1) y el volumen de poro (0. 026 cm3∙g-1) de UWC-700 muestran que la mayoría de los poros están llenos de cristales de Na2CO3. El área de superficie y el volumen de poro de HEC-700 son casi los mismos que los de Co/C-700, lo que significa que la estructura de carbono se conserva bien durante los pasos de grabado. Además, el volumen de mesoporo en HEC-700 (Tabla S1) aumentó un 5,4 % después del grabado, lo que confirma que las nanopartículas de Co tenían un tamaño mesoporoso.
La morfología y la estructura de Co / C-700 se caracterizaron por SEM (Fig. S4) y TEM (Fig. 3 (a, b)). Las partículas Co/C-700 muestran la estructura de una capa de carbono interconectada en 3D. La imagen TEM (HRTEM) de alta resolución (Fig. 3 (c)) muestra además que las franjas de la red de la nanopartícula con un espacio d de 0,205 nm corresponde al plano (111) de cobalto metálico. El espacio d de las franjas torcidas que envuelven la nanopartícula (0,35 nm) concuerda bien con el plano (002) del carbono grafítico. Las imágenes de mapeo de EDS (Fig. 3 (d)) muestran la distribución de los elementos Co, C y O, lo que confirma que el elemento cobalto se dispersa uniformemente en las capas de carbono.
Tabla S1 Área de superficie BET y distribución del volumen de poros de UWC-700, Co/C-700 y HEC-700
|
Muestra |
SBET/(m2∙g-1) |
Vtotal/(cm3∙g-1) |
Volumen de poros mi/% |
||
|
Micro |
meso |
Macro |
|||
|
UWC-700 |
15.09 |
0.026 |
1.76 |
98.24 |
0 |
|
Co/C-700 |
376.13 |
0.52 |
28.85 |
62.76 |
8.49 |
|
HEC-700 |
369.53 |
0.54 |
25.47 |
68.17 |
6.36 |

Fig. 3 (a, b) TEM, (c) imágenes TEM de alta resolución (HRTEM) y (d) mapeos elementales EDS (Co, C y O) de Co/C-700
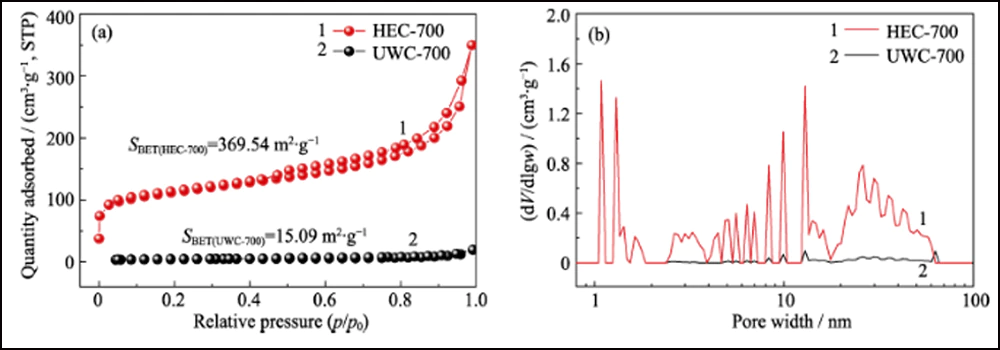
Fig. S3 Isotermas de adsorción/desorción de N2 (a) y distribuciones de tamaño de poro (b) de UWC-700 y HEC-700

Fig. S4 Imagen SEM de Co/C-700
Para confirmar aún más el efecto electroquímico de las Conanopartículas en las baterías de Li-S, se empleó HEC-700 como muestra de control. El patrón XRD, la imagen SEM (Fig. S5) y los datos BET muestran que HEC-700 posee casi la misma estructura que Co/C-700, excepto la existencia del elemento Co. Los electrodos S@Co/C-700 y S@HEC-700 se prepararon como cátodos para baterías de Li-S. Como se muestra en la Fig. S6, la principal pérdida de peso entre la temperatura ambiente y 450 ℃ se atribuye a la sublimación del azufre, correspondiente al contenido de azufre del 70,99 % en peso y el 68,42 % en peso en S@Co/C-700 y S@HEC - 700, respectivamente.
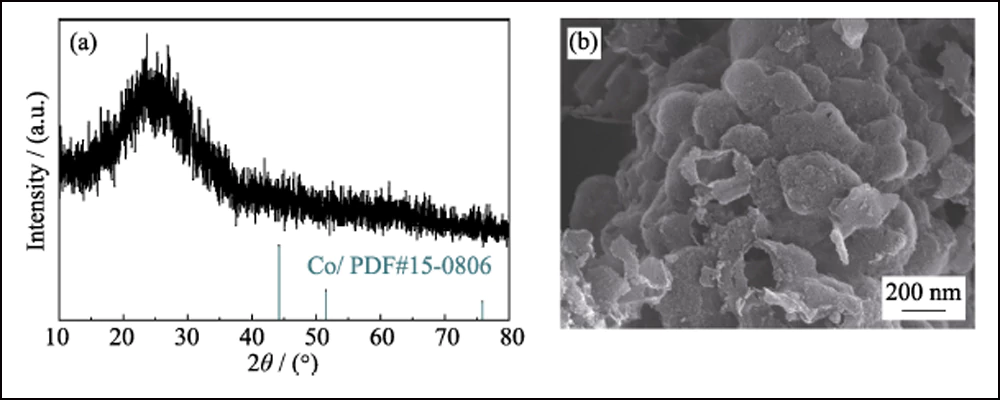
Fig. S5 Patrón XRD (a) e imagen SEM (b) de HEC-700
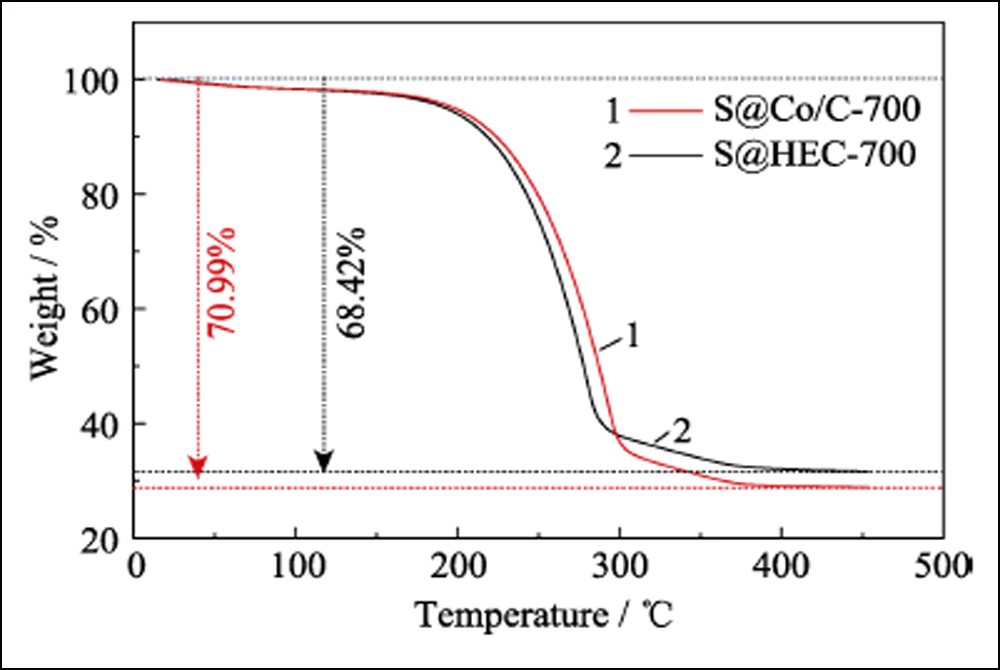
Fig. S6 Curvas TGA de S@Co/C-700 y S@HEC-700 en atmósfera de N2
XPS investigó la composición superficial de S@Co/C-700. El espectro de la encuesta (Fig. S7) muestra la presencia de elementos S, C, N, O y Co en la superficie del compuesto. El pequeño N es del precursor de Co(NO3)2. La proporción extremadamente baja de azufre (7,83% at) indica que el cristal de azufre se ha infiltrado con éxito en la estructura porosa. El espectro de alta resolución de S2p (Fig. 4(a)) muestra cuatro picos principales. Los picos a 164 y 165,2 eV corresponden a S2p3/2 y S2p1/2, respectivamente. Los picos ubicados en 169 y 170,1 eV se atribuyen al tiosulfato y al S-Co, respectivamente. El espectro C1s se presenta en la Fig. 4 (b). Los picos en 284.8, 285.6 y 288.8 eV corresponden a enlaces CC, CO y O=CO, casi lo mismo que el espectro C1s de Co/C-700 (Fig. S8(a)). Y el espectro de O1s (Fig. 4(c)) muestra el O=C, OC y O= CO a 531,6, 532,4 y 533,4 eV, respectivamente. Cuando se compara con Co/C-700 (Fig. S8 (b)), todos estos picos se desplazan más de 0,5 eV y verifican aún más la interacción entre los grupos funcionales de azufre y oxígeno. Además, el espectro de Co2p en la Fig. 4(d) muestra dos picos principales de Co2p3/2 y Co2p1/2 a 780,3 y 797,9 eV, que representan el metal cobalto. A diferencia de las curvas de Co/C-700 (Fig. S8(c)), aparecen dos picos adicionales en 783,7 y 800,4 eV en S@Co/C-700 que sugieren la fuerte interacción entre el azufre y el cobalto. La prueba de adsorción estática se empleó para investigar la interacción entre LiPS y Co/C-700 o HEC-700 de manera más intuitiva. Y la fotografía revela la solución incolora de Co/C-700 y el color casi sin cambios de HEC-700 (Fig. S9).
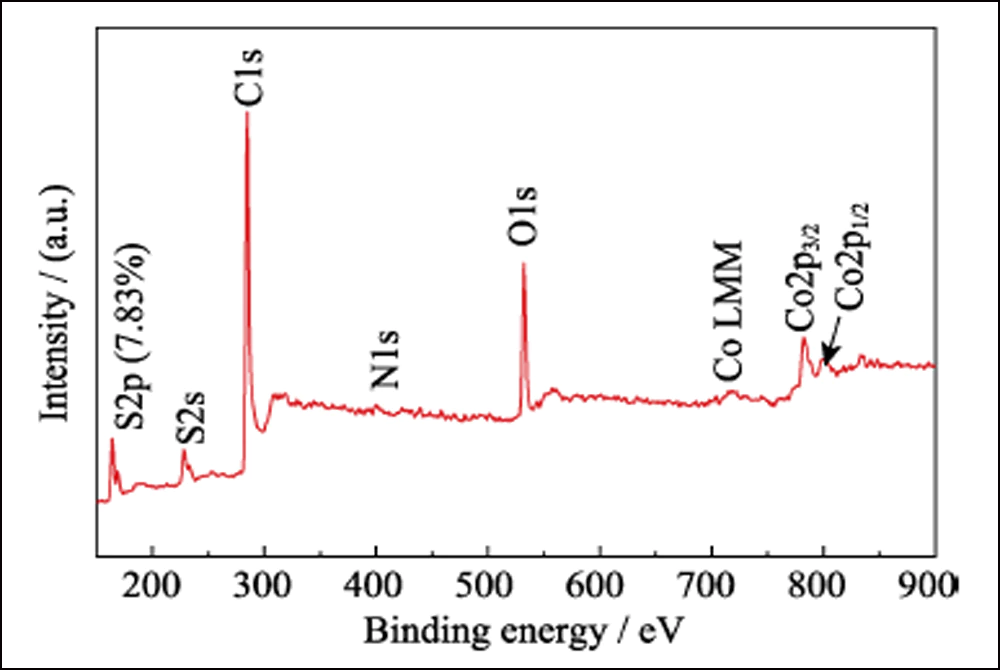
Fig. S7 Espectro XPS del compuesto S@Co/C-700
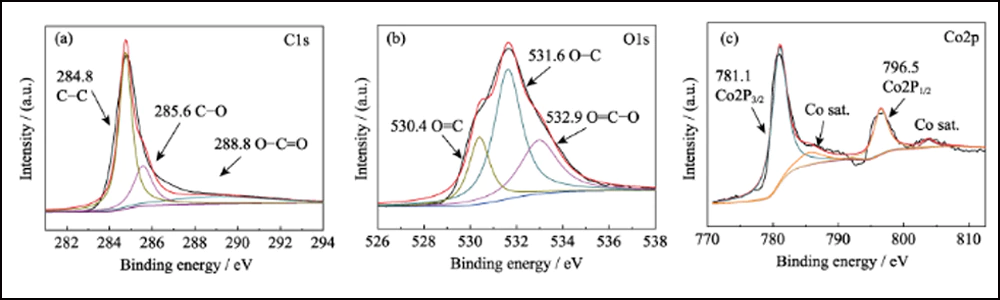
Fig. S8 Espectros XPS de alta resolución de Co/C-700(a) C1s; (b) O1; (c) Co2p
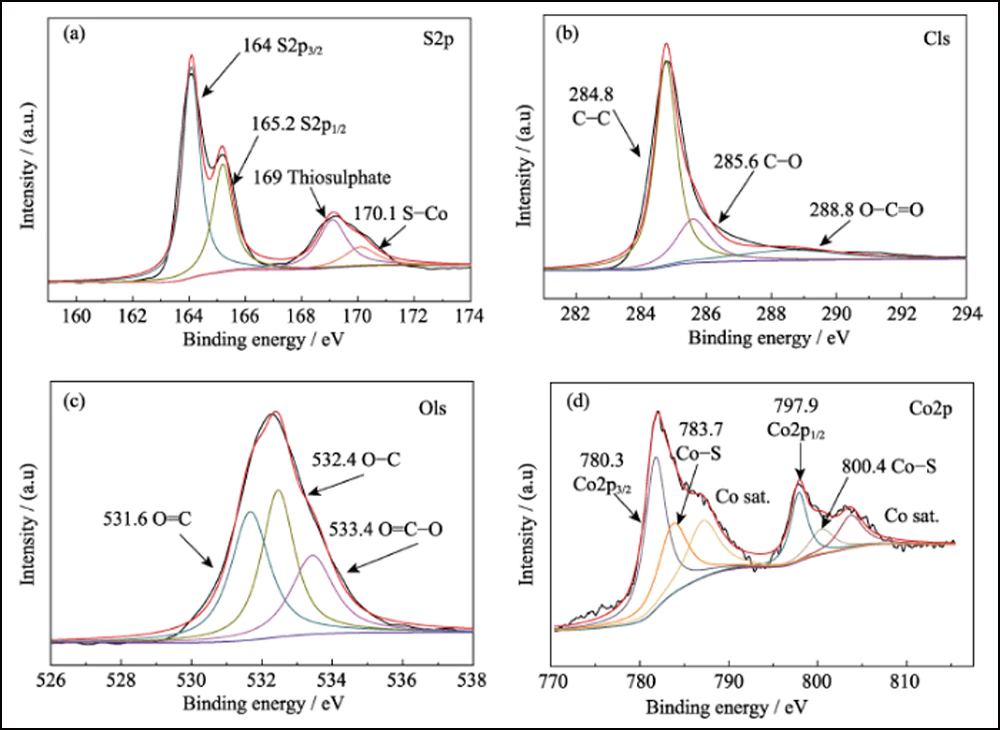
Fig. 4 Espectros XPS de alta resolución para composites S@Co/C-700
(a) S2p; (b) C1; (c) O1; (d) Co2p

Fig. S9 Fotografía de la prueba de adsorción estática de HEC-700 y Co/C-700 después de reposar durante 1 h
Además de la adsorción efectiva y la fuerte interacción, las nanopartículas de cobalto dopantes pueden mejorar de manera eficiente la cinética de la reacción de conversión entre S8 y Li2S. Se utilizó voltamperometría cíclica (CV) de las celdas simétricas con electrodos Co/C-700 y HEC-700 para confirmar el efecto de las nanopartículas de cobalto. Las curvas de CV en la Fig. 5 (a) revelan claramente ocho picos redox con gran superposición (Fig. S10 (a)). La separación y la estabilidad de los picos redox indican la reversibilidad y la cinética mejoradas de la reacción de conversión. Además, la curva de la primera exploración a -1 V revela tres picos que representan la reducción gradual del Li2S6 original al Li2S insoluble en el electrodo de trabajo y la oxidación del Li2S6 en el contraelectrodo. Los cuatro picos en -0.112, 0.093, 0.326 y 0. 401 V representan la oxidación por etapas de Li2S a elemento azufre en el electrodo de trabajo. Por tanto, el pico a 0,112 V corresponde a la reducción de S8 a Li2S6. Además, los picos con buena sustentabilidad bajo velocidades de exploración más altas (Fig. S10 (b)) también indican el proceso electroquímico eficiente basado en los electrodos Co/C-700. En contraste, el control experimental de los electrodos HEC-700 muestra solo dos pares de picos anchos (Fig. 5 (b)) con la deriva cíclica (Fig. S10 (c)), y los picos discretos a -0.264/0.264 V se vuelven invisible a velocidades más altas (Fig. S10 (d)), lo que indica la cinética lenta y la conversión incompleta de la reacción de polisulfuros sin la existencia de nanopartículas de Co. los picos con buena sustentabilidad bajo velocidades de exploración más altas (Fig. S10 (b)) también indican el proceso electroquímico eficiente basado en los electrodos Co/C-700. En contraste, el control experimental de los electrodos HEC-700 muestra solo dos pares de picos anchos (Fig. 5 (b)) con la deriva cíclica (Fig. S10 (c)), y los picos discretos a -0.264/0.264 V se vuelven invisible a velocidades más altas (Fig. S10 (d)), lo que indica la cinética lenta y la conversión incompleta de la reacción de polisulfuros sin la existencia de nanopartículas de Co. los picos con buena sustentabilidad bajo velocidades de exploración más altas (Fig. S10 (b)) también indican el proceso electroquímico eficiente basado en los electrodos Co/C-700. En contraste, el control experimental de los electrodos HEC-700 muestra solo dos pares de picos anchos (Fig. 5 (b)) con la deriva cíclica (Fig. S10 (c)), y los picos discretos a -0.264/0.264 V se vuelven invisible a velocidades más altas (Fig. S10 (d)), lo que indica la cinética lenta y la conversión incompleta de la reacción de polisulfuros sin la existencia de nanopartículas de Co.
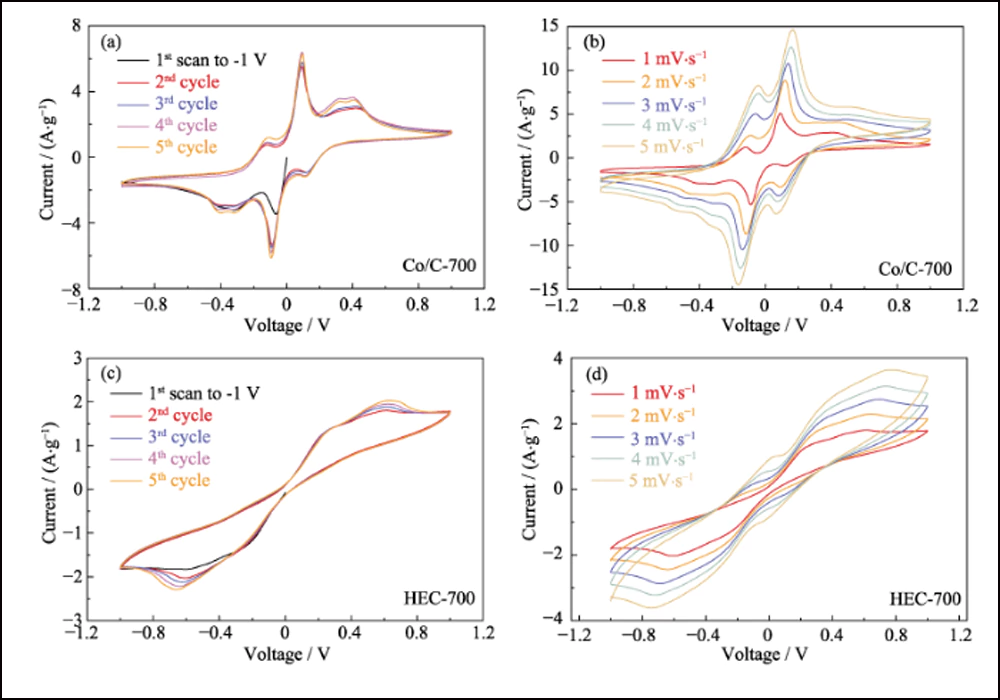
Fig. S10 Curvas CV de ciclos múltiples de celdas simétricas basadas en Co/C-700 a 1 mV∙s-1 (a) y velocidades aumentadas (b), y curvas CV de ciclos múltiples de HEC-700 a 1 mV∙s- 1 (c) y aumento de las tasas (d)
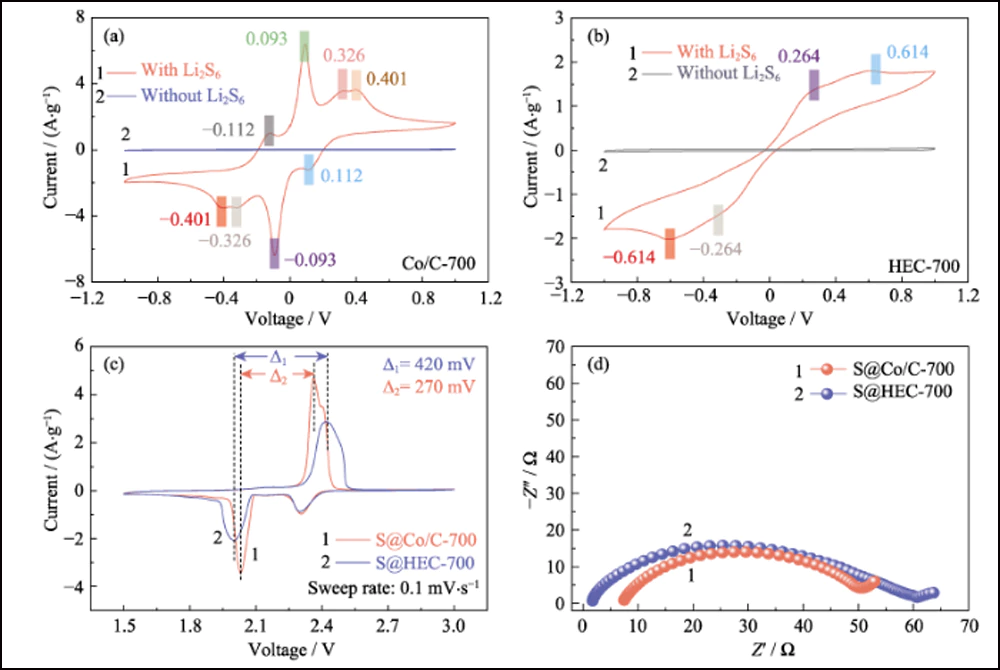
Fig. 5 Curvas de CV de (a) celdas simétricas basadas en Co/C-700 y (b) HEC-700 con y sin 0,2 mol∙L-1 de Li2S6 a 1 mV∙s-1; (c) curvas CV y (d) diagramas EIS de electrodos S@Co/C-700 y S@HEC-700
Para confirmar aún más la cinética electroquímica mejorada en presencia de nanopartículas de cobalto, las pruebas CV de los electrodos S@Co/C-700 y S@HEC-700 (Fig. 5(c)) se midieron a una velocidad de exploración de 0,1 mV∙ s-1. Para el proceso de reducción catódica de S@Co/C-700, dos picos reversibles a 2.306 y 2.031 V están asociados con la transformación de azufre a LiPS soluble y una mayor reducción a Li2S2/Li2S insoluble, respectivamente. En comparación, el último pico de reducción de S@HEC-700 muestra un cambio negativo significativo. Sugiere una cinética de reacción más lenta, lo que puede aumentar el tiempo de detención de los LiPS y agravar el efecto de transporte. Para el proceso anódico, el proceso de oxidación de S@Co/C-700 revela un pico discreto a 2,397 V y un pico importante a 2,361 V, correspondiente a la oxidación de Li2S2/Li2S a LiPS y luego a azufre, respectivamente. La separación de los picos de oxidación muestra la cinética mejorada de la primera reacción. Además, el intervalo entre el segundo pico de reducción y el pico de oxidación principal de S@Co/C-700 (270 mV, Fig. 5(c)) es significativamente menor que el de S@HEC-700 (420 mV), lo que indica el sobrepotencial de polarización reducido y la cinética mejorada de la reacción redox con la existencia de cobalto. Las curvas EIS (Fig. 5(d)) muestran una menor resistencia de transferencia de carga (el tamaño de un semicírculo de alta frecuencia) del electrodo S@Co/C-700 (43,1 Ω) que la del S@HEC-700 (58,7 Ω ), que también revela la cinética de reacción mejorada por el cobalto. 5 (c)) es significativamente más pequeño que el de S @ HEC-700 (420 mV), lo que indica el sobrepotencial de polarización reducido y la cinética mejorada de la reacción redox con la existencia de cobalto. Las curvas EIS (Fig. 5(d)) muestran una menor resistencia de transferencia de carga (el tamaño de un semicírculo de alta frecuencia) del electrodo S@Co/C-700 (43,1 Ω) que la del S@HEC-700 (58,7 Ω ), que también revela la cinética de reacción mejorada por el cobalto. 5 (c)) es significativamente más pequeño que el de S @ HEC-700 (420 mV), lo que indica el sobrepotencial de polarización reducido y la cinética mejorada de la reacción redox con la existencia de cobalto. Las curvas EIS (Fig. 5(d)) muestran una menor resistencia de transferencia de carga (el tamaño de un semicírculo de alta frecuencia) del electrodo S@Co/C-700 (43,1 Ω) que la del S@HEC-700 (58,7 Ω ), que también revela la cinética de reacción mejorada por el cobalto.
La figura 6 compara el rendimiento electroquímico de los cátodos S@Co/C-700 y S@HEC-700. Las capacidades de velocidad de S@Co/C-700 (Fig. 6(a)) muestran una capacidad de descarga inicial mucho mayor (1280 mAh∙g-1) que S@HEC-700 (847 mAh∙g-1) en el tasa de corriente de 0.5C (1C = 1672 mAh∙g-1). A velocidades de ciclo más altas de 1C, 2C, 5C y 10C, las capacidades de descarga del cátodo S@Co/C-700 alcanzan 1058, 948, 867 y 797 mAh∙g-1, y luego se recuperan a 968 mAh∙g-1 en 1C (95 % del 10° ciclo). Y los perfiles de voltaje de carga-descarga galvanostática a diferentes velocidades muestran que el electrodo S@Co/C-700 ejerce un sobrepotencial más pequeño y una meseta de descarga mucho más prolongada incluso a 10 °C (Fig. S11). Las estabilidades de ciclo de los dos cátodos a una tasa de 1C se comparan en la Fig. 6 (b). El cátodo S@Co/C-700 muestra una alta capacidad inicial de 1244 mAh∙g-1, y mantiene 770 mAh∙g-1 después de 200 ciclos con una alta eficiencia de Coulomb (superior al 96 %), revelando una capacidad mucho mayor y una mejor estabilidad que el S@HEC-700. Los rendimientos de ciclismo a largo plazo en 2C se muestran en la Fig. S12 (a). Después de 600 ciclos, el cátodo S@Co/C-700 mantuvo una capacidad de descarga de 401,7 mAh∙g-1 (65,3 mAh∙g-1 para S@HEC-700). Las tasas extremadamente altas a 5C y 10C se evalúan más a fondo para el cátodo S@Co/C-700 (Fig. S12(b)). Muestra altas capacidades de descarga inicial (1098 y 772 mAh∙g-1 a 5C y 10C, respectivamente) sin ningún paso de activación y rendimiento de ciclo estable (518 y 416 mAh∙g-1 a 5C y 10C, respectivamente) durante más de 200 ciclos La estabilidad de ciclo y el rendimiento de velocidad más excelentes del electrodo S@Co/C-700 se atribuyen a los beneficios de las nanopartículas de cobalto.
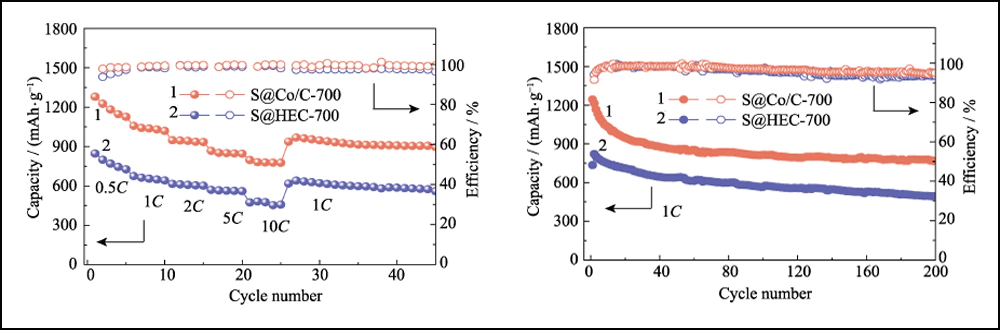
Fig. 6 (a) Capacidades de tasa a varias tasas de 0.5C a 10C y (b) estabilidades de ciclo a 1C para electrodos S@Co/C-700 y S@HEC-700
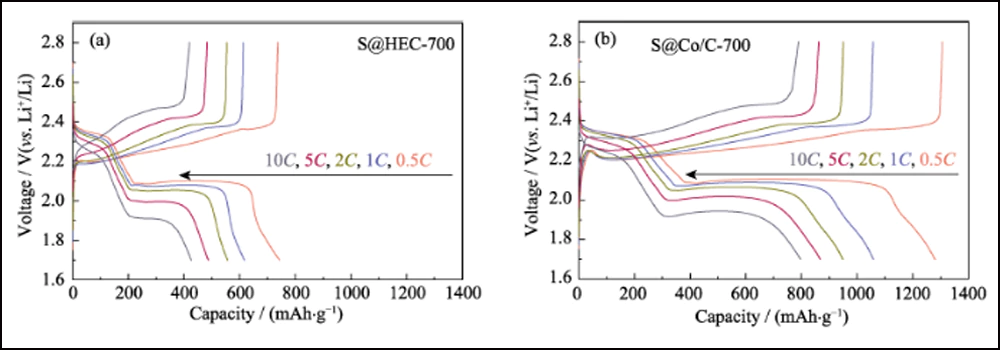
Fig. S11 Perfiles de voltaje de los electrodos S@HEC-700 (a) y S@Co/C-700 (b) a varias velocidades de 0,5 C a 10 C
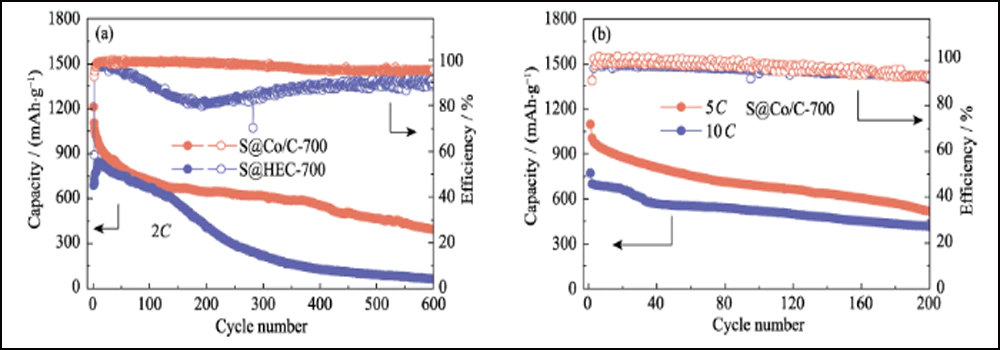
Fig. S12 (a) Estabilidades de ciclo de los electrodos S@Co/C-700 y S@HEC-700 a 2C; (b) Rendimiento de ciclismo de S@Co/C-700 a 5C y 10C
3 Conclusión
En resumen, diseñamos una síntesis a gran escala de compuestos Co/C-700 como material huésped para soportar el azufre de las baterías de Li-S. Combinando con los resultados de CV y EIS, concluimos que las nanopartículas de Co incrustadas disminuyen el sobrepotencial y promueven la cinética de conversión de LiPS. Además, el XPS y la prueba de adsorción estática muestran la fuerte interacción entre los LiPS y el Co dopado. Con la cooperación del Co y la estructura porosa hueca única, los cátodos S@Co/C-700 obtenidos exhiben una alta capacidad específica de 1280 mAh∙g. -1 a 0.5C y rendimiento estable de ciclo largo de 1C a 10C. Este trabajo demuestra la viabilidad de las baterías Li-S de alta densidad de energía con el dopante de metal cobalto para requisitos de alta velocidad.
Materiales de apoyo
Marco de carbono hueco dopado con cobalto como huésped de azufre para el cátodo de la batería de azufre de litio
JIN Gaoyao, HE Haichuan, WU Jie, ZHANG Mengyuan, LI Yajuan, LIU Younian
Laboratorio clave provincial de Hunan de ciencia de interfaz de micro y nanomateriales, Facultad de química e ingeniería química, Universidad Central del Sur, Changsha 410083, China
Caracterización de materiales
Las estructuras cristalinas de las muestras sintetizadas se caracterizaron por difracción de potencia de rayos X (XRD, Dmax/2550VB, Rigaku, Japón) con radiación Cu Kα. La morfología superficial y la microestructura se obtuvieron mediante microscopía electrónica de barrido (SEM, FEI Verios 460). Se utilizó microscopía electrónica de transmisión (TEM, JEM-2100F) equipada con un espectrómetro de dispersión de energía de rayos X (EDS) para recopilar imágenes de transmisión y de alta resolución del Co/C-700. El contenido de Co en Co/C-700 y el contenido de S en S@Co/C-700 o S@HEC-700 se determinaron mediante analizador termogravimétrico (TGA, Q600, EE. UU.) en aire o N2, respectivamente, con una velocidad de calentamiento de 10 ℃∙min-1. La espectroscopia Raman se realizó utilizando un sistema reflejo Raman (Renishaw en el microscopio Via Raman, Reino Unido) equipado con un microscopio bajo radiación láser de 532 nm a 50 mW. El análisis del espectrómetro de fotoelectrones de rayos X (XPS) se realizó en un espectrómetro de fotoelectrones de rayos X ESCALAB 250XI (Thermo Fisher Scientific, EE. UU.). El área de superficie específica y la distribución del tamaño de poro de las muestras se determinaron mediante análisis de adsorción-desorción de nitrógeno.
Adsorción estática de polisulfuros
Por lo general, se obtuvo una solución de Li2S6 de 0,003 mol/L al hacer reaccionar Li2S y S estequiométricos en 1,2-dimetoxietano (DME) y 1,3-dioxolano (DOL) (1: 1 en volumen) a 60 ℃ durante 24 h. Luego, se agregaron 10 mg de Co/C-700 o HEC-700 a 3 ml de la solución de polisulfuro de litio. La fotografía se tomó después de que la muestra reposara durante 1 hora.