WANG Kunpeng, 1, LIU Zhaolin2, LIN Cunsheng2, WANG Zhiyu, 1,2
1. Laboratorio Estatal Clave de Química Fina, Escuela de Ingeniería Química, Universidad Tecnológica de Dalian, Dalian 116024, China
2. Sucursal de desarrollo de nuevos materiales, Valiant Co., Ltd., Yantai 265503, China
Resumen
En comparación con las baterías de iones de litio, las baterías de iones de Na ofrecen los beneficios de bajo costo, buen rendimiento a baja temperatura y seguridad, lo que atrae gran atención en las aplicaciones sensibles al costo y la confiabilidad. Con alta capacidad y bajo costo, los materiales similares al azul de Prusia (PBA) se presentan como materiales catódicos prometedores para baterías de iones de Na. Sin embargo, la presencia de agua cristalina dentro de su estructura induce una rápida disminución del rendimiento de la batería, lo que constituye un cuello de botella crítico que limita su aplicación. Este trabajo informa una estrategia sencilla de tratamiento térmico para eliminar eficazmente el agua cristalina de los materiales catódicos de PBA, mejorando la retención de capacidad del 73% al 88% después de 340 ciclos. El análisis in situ revela que la pérdida inicial de eficiencia Coulombic del cátodo de PBA es el resultado de su transformación irreversible de una forma trigonal a una fase cúbica durante el proceso de carga y descarga. Este problema se puede solucionar introduciendo Na2C2O4 para compensar la pérdida irreversible de Na en el cátodo. Sobre esta base, se construye una batería de iones de Na de estado casi sólido de alto rendimiento combinando un cátodo de PBA de bajo contenido de agua con un aditivo de Na2C2O4 y un ánodo de carbono duro (HC) dentro de un diacrilato de poli(etilenglicol) (PEGDA). )-electrolito de estado casi sólido a base de alta conductividad iónica y estabilidad electroquímica. Esta batería exhibe capacidades específicas que van de 58 a 105 mAh·g-1 con densidades de corriente de 20 a 500 mA·g-1, capaz de mantener ciclos estables durante más de 200 ciclos. Este estudio subraya la mejora significativa en la estabilidad y capacidad de los materiales catódicos de PBA mediante la eliminación eficiente del agua cristalina que contienen.Palabras clave: batería de iones de Na; batería de estado casi sólido; cátodo azul de Prusia; análisis in situ
El desarrollo de tecnología de baterías de alto rendimiento es una necesidad estratégica importante para que China transforme y mejore su estructura energética, promueva una economía limpia con bajas emisiones de carbono y alcance el objetivo de "neutralidad de carbono y pico de carbono". Las baterías de iones de litio son uno de los sistemas de baterías de alta eficiencia más utilizados. Sin embargo, la abundancia de litio en la corteza terrestre es sólo del 0,0065%, las reservas de recursos de litio de China representan sólo el 7% del total mundial y casi el 70% del carbonato de litio se importa. Será difícil satisfacer la enorme demanda en el campo del almacenamiento de energía y las baterías eléctricas en el futuro. La abundancia de sodio en la corteza terrestre es más de 400 veces mayor que la de litio. Las reservas de sodio de China representan aproximadamente el 22% de las reservas totales del mundo. Desde la perspectiva de los costos de las materias primas, el costo de las baterías de iones de sodio se puede reducir entre un 30% y un 40% en comparación con las baterías de iones de litio. Además, en comparación con las baterías de iones de litio, las baterías de iones de sodio tienen un mejor rendimiento a baja temperatura, un rango de temperatura de funcionamiento más amplio y mayor seguridad. Estas ventajas únicas los han convertido en un foco de atención en aplicaciones de almacenamiento de energía sensibles a los costos y críticas para la seguridad [1].
Impulsada por el objetivo del "carbono dual", la demanda de China de almacenamiento de energía y baterías eléctricas alcanzó los 158,5 GWh en 2020, y se espera que la demanda mundial de baterías entre en la era de los TWh en 2025. Con el avance de la tecnología de baterías, la densidad de energía de El uso de baterías ha aumentado rápidamente y los requisitos de seguridad de las baterías se han vuelto cada vez más importantes. Las baterías tradicionales de iones de litio/sodio utilizan electrolitos orgánicos líquidos que son propensos a sufrir fugas, lo que reduce la confiabilidad de la batería [2-3]. El uso de baterías de estado sólido con alta estabilidad termoeléctrica, alta resistencia mecánica y sin riesgo de fugas es una dirección factible para resolver el problema de confiabilidad [4-5], pero tiene problemas como alta densidad de electrolitos sólidos, baja conductividad iónica y mal contacto con la interfaz "sólido-sólido" de los electrodos [6]. Los electrolitos cuasi sólidos entre líquidos y sólidos tienen mejor estabilidad y seguridad que los electrolitos líquidos, y son superiores a los electrolitos sólidos en términos de conductividad iónica, flexibilidad y compatibilidad de interfaz [7â-9]. Estas ventajas hacen que las baterías de estado cuasi sólido basadas en ellas sean una de las direcciones de enfoque más factibles en el campo de la tecnología avanzada de baterías.
Los compuestos de azul de Prusia (PBA) son actualmente los materiales catódicos más populares para las baterías de iones de sodio. Su estructura de esqueleto abierto y abundantes sitios de almacenamiento de sodio les confieren una alta capacidad teórica específica (170 mAh g-1) y un buen rendimiento de transporte de iones [10-11]. En las baterías de estado sólido, los PBA se pueden utilizar no sólo como materiales catódicos sino también como electrolitos sólidos [12-13]. Sin embargo, los PBA generalmente se preparan mediante precipitación en solución, lo que formará defectos de vacancia de Fe (CN) 64- y una gran cantidad de agua cristalina en su estructura, lo que dificulta la incorporación de Na+ en la red de los PBA y limita su capacidad de almacenamiento de sodio. Además, el agua cristalina de los PBA se liberará gradualmente en el electrolito durante la reacción de la batería, lo que provocará una rápida disminución del rendimiento de la batería, reacciones secundarias, flatulencias y otros problemas [11,14]. Estos problemas limitan la aplicación de PBA en baterías de estado sólido y dificultan su combinación con la mayoría de los electrolitos sólidos inorgánicos sensibles al agua. La formación de defectos de vacancia y agua cristalina en PBA puede inhibirse eficazmente mediante estrategias como el tratamiento hidrotermal[15], la coprecipitación lenta[16], la inhibición de la oxidación de Fe2+[17], el grabado químico[18] y el dopaje de elementos[19- 20]. Sin embargo, los procesos técnicos relevantes son complejos y difíciles de controlar con precisión, y también es necesario mejorar el rendimiento de los cátodos de PBA obtenidos. En vista de los problemas anteriores, este estudio propone un método de tratamiento térmico simple y eficiente para reducir el contenido de agua cristalina en los PBA y mejorar su estabilidad en el almacenamiento de sodio. Mediante tecnología de polimerización in situ, se desarrolló un electrolito sólido de referencia de diacrilato de polietilenglicol (PEGDA) con alta conductividad iónica y alta estabilidad electroquímica. Sobre esta base, el cátodo de PBA de bajo contenido de agua y el ánodo de carbono duro (HC) se combinaron en el electrolito sólido de referencia PEGDA, y se añadió Na2C2O4 al cátodo como compensador de sodio autosacrificado para construir un cuasi-electrolito de alto rendimiento. Batería de iones de sodio de estado sólido. El mecanismo dinámico de almacenamiento de sodio del cátodo de PBA y del ánodo de HC fue revelado mediante tecnología de análisis in situ.
1 Método experimental
1.1 Preparación del cátodo de PBA con bajo contenido de agua
Se disolvieron 28 116 mmol de citrato de sodio y 24 mmol de FeSO4 · 7H2O en 400 ml de agua desionizada desoxigenada. Se disolvieron 116 mmol de citrato de sodio y 26 mmol de Na4Fe(CN)6 en 400 ml de agua desionizada desoxigenada. La solución que contenía FeSO4 se añadió lentamente a la solución que contenía Na4Fe(CN)6 y la reacción se agitó a temperatura constante durante 6 h. El producto se lavó tres veces mediante centrifugación con etanol y agua desionizada desoxigenada y se secó al vacío a 120 °C durante 24 h para obtener PBA con alto contenido de agua cristalina (Hw-PBA). Se colocó en un horno tubular protegido con argón y se calcinó a 270 °C durante 2 h para obtener PBA de bajo contenido de agua (Lw-PBA), con una velocidad de calentamiento de 0,5 °C·min-1.
1.2 Caracterización de la muestra
La morfología y estructura de la muestra se analizaron utilizando un microscopio electrónico de barrido por emisión de campo. La composición química de la muestra se analizó utilizando un espectrómetro de fotoelectrones de rayos X y un espectrómetro de emisión de plasma acoplado inductivamente. La batería se analizó in situ mediante un difractómetro de rayos X de polvo y espectroscopía láser Raman. El contenido de agua cristalina de la muestra se analizó utilizando un analizador termogravimétrico en una atmósfera de argón a una velocidad de calentamiento de 10 ·min-1.
1.3 Ensamblaje de la batería y pruebas de rendimiento electroquímico
1.3.1 Conjunto de media batería de iones de sodio líquido
Se ensamblaron pilas de botón CR2016 para realizar pruebas. Se mezclaron uniformemente material de cátodo azul de Prusia (Hw-PBA o Lw-PBA), negro de Ketjen (KB) y aglutinante de fluoruro de polivinilideno (PVDF) en una proporción de masa de 8:1:1, se añadió N-metilpirrolidona (NMP) como disolvente y dispersante, y la suspensión resultante se recubrió uniformemente sobre una lámina de aluminio recubierta de carbono como cátodo, con una carga de material activo de 3~4 mg·cm-2. Se utilizaron láminas de sodio metálico como contraelectrodos y electrodos de referencia. El electrolito era una solución de DMC/EC (DMC: carbonato de dimetilo, EC: carbonato de etileno, relación de volumen 1:1) de 1,0 mol·L-1 NaClO4 y carbonato de fluoroetileno (FEC) al 5,0%. La batería se montó en una caja de guantes llena de argón (contenido de agua <10-7, contenido de oxígeno <10-7).
1.3.2 Conjunto de batería completa de iones de sodio líquido
El electrodo positivo se preparó usando el método anterior, se usó HC como electrodo negativo y la relación N/P de los electrodos positivo y negativo se controló en 1,1~1,2. La batería se montó en una caja con guantes llena de argón (contenido de agua <10-7, contenido de oxígeno <10-7) utilizando el electrolito anterior.
1.3.3 Preparación de electrolito cuasi sólido
Se mezcló PEGDA con el electrolito líquido anterior en una relación de masa de 7:93. Se añadió azobisisobutironitrilo (AIBN) al 5,0 % como iniciador de la polimerización para formar una solución precursora de electrolito cuasi sólido. Esta solución se calentó a 60 °C durante 10 h para formar un electrolito casi sólido.
1.3.4 Montaje de una batería completa de iones de sodio de estado casi sólido
El material del electrodo positivo, el suplemento de sodio Na2C2O4, el agente conductor KB y el aglutinante de PVDF se mezclaron uniformemente en una proporción de masa de 6,4: 1,6: 1,0: 1,0, se añadió NMP como disolvente y dispersante, y la suspensión obtenida se recubrió uniformemente sobre una capa de carbono. -Papel de aluminio recubierto como electrodo positivo, con una carga de material activo de 3~4 mg·cm-2. Se utilizó HC como electrodo negativo y la relación N/P de los electrodos positivo y negativo se controló en 1,1~1,2. La solución precursora del electrolito cuasi sólido se añadió a la batería y, después de encapsularla, se calentó a 60 °C durante 10 h para obtener una batería de estado cuasi sólido. La batería se montó en una caja con guantes llena de argón (contenido de agua <10-7, contenido de oxígeno <10-7).
1.3.5 Prueba de rendimiento de la batería
La conductividad iónica del electrolito cuasi sólido se probó mediante espectroscopia de impedancia electroquímica (EIS) utilizando una estación de trabajo electroquímica. El rango de frecuencia de prueba fue de 1 Hz ~ 1000 kHz y la amplitud del voltaje de perturbación fue de 5,0 mV. La ventana de estabilidad electroquímica del electrolito cuasi sólido se probó mediante voltamperometría de barrido lineal (LSV) con una velocidad de barrido de 5 mV·s-1. El material y el rendimiento de la batería se estudiaron mediante el método de carga y descarga de corriente constante utilizando un probador de baterías Land CT2001A. La ventana de voltaje de media celda fue de 2,0~3,8 V (frente a Na/Na+), la ventana de voltaje de celda completa fue de 1,5~3,8 V y la densidad de corriente fue de 10~500 mA·g-1. Al probar la estabilidad del ciclo, primero se ciclaron la batería 5 veces a una densidad de corriente de 50 mA·g-1, y luego se realizó la prueba de estabilidad del ciclo a diferentes densidades de corriente.
2 Resultados y discusión
2.1 Análisis de morfología y composición
La curva TGA de Hw-PBA en la Figura 1 (a) muestra dos regiones de rápida pérdida de peso: 1) temperatura ambiente a 270 °C, 2) 440 a 580 °C. En la primera región, la pérdida de peso desde temperatura ambiente hasta 120 °C (fracción de masa 3,1%) se debe a la eliminación del agua adsorbida; la pérdida de peso de 120 a 200 °C (fracción de masa 6,10%) es causada por la eliminación de agua intersticial en la estructura estructural de los PBA; la pérdida de peso de 200 a 270 °C (fracción de masa 6,89%) corresponde a la eliminación del agua cristalina en los PBA. Por lo tanto, se seleccionó un tratamiento térmico a 270 °C para eliminar el agua de los Hw-PBA. Después del tratamiento térmico a esta temperatura, los Lw-PBA obtenidos solo perdieron alrededor del 1,18 % de su peso a temperatura ambiente ~270 °C, que fue un 92,67 % menor que el de los Hw-PBA; y perdieron alrededor del 0,74 % de su peso a 200 ~ 270 °C, que fue un 89,26 % menor que el de los Hw-PBA. Los resultados anteriores muestran que el tratamiento térmico puede eliminar eficazmente diferentes tipos de agua en los PBA, y los PBA con bajo contenido de agua obtenidos tienen buena estabilidad térmica.
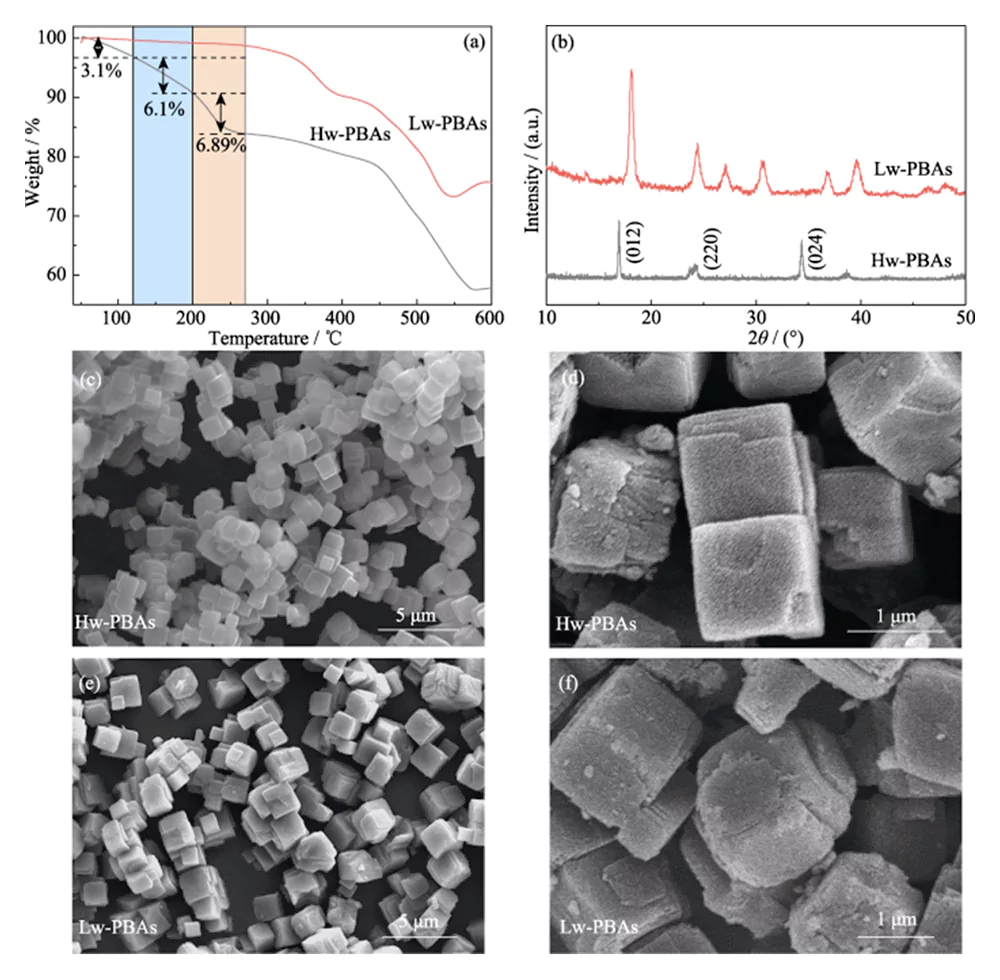
Fig. 1 TGA, análisis de morfología y estructura del cátodo de PBA
(a) curvas TGA y (b) patrones XRD de Hw-PBA y Lw-PBA; (c-f) Imágenes SEM de (c, d) Hw-PBA y (e, f) Lw-PBA
La Figura 1 (b) muestra los espectros XRD de Hw-PBA y Lw-PBA. Los picos de difracción de Hw-PBA a 2θ = 17,0°, 24,0° y 34,4° corresponden a los planos cristalinos (012), (220) y (024), respectivamente. Después del tratamiento térmico, el pico de difracción correspondiente al plano cristalino (024) desaparece, lo que indica que el agua cristalina se elimina con éxito, y las posiciones del pico de difracción correspondientes a los planos cristalinos (012) y (220) se mueven a ángulos más altos, lo que indica que el volumen de la celda unitaria disminuye después de que se elimina el agua cristalina. Además, aparecen nuevos picos de difracción en 2θ=27,1°, 30,7° y 36,9°, lo que indica que se forma una estructura cristalina trigonal después del tratamiento térmico. El análisis SEM (Figura 1 (c ~ e)) muestra que los Hw-PBA y los Lw-PBA tienen morfologías cúbicas similares con un tamaño promedio de 2 ~ 3 µm. La superficie de las partículas de Lw-PBA obtenidas después del tratamiento térmico es ligeramente rugosa (Figura 1 (f)), pero debido a la baja temperatura del tratamiento térmico, no se produjo ninguna fusión ni aglomeración evidente. Se estimó que la composición de Lw-PBA era Na1,91Fe-[Fe(CN)6]·3,2H2O analizando el contenido de elementos metálicos mediante ICP-OES y midiendo el contenido de agua mediante TGA.Para explorar más a fondo la composición química y la estructura de Hw-PBA y Lw-PBA, se realizó un análisis XPS. En el espectro Fe2p XPS de alta resolución de Hw-PBA, los dos picos característicos con energías de unión de 708,6 y 721,4 eV corresponden a Fe (II) y Fe (III), respectivamente (Figura 2 (a)). Fe (II) y Fe (III) también existen en Lw-PBA, pero la proporción de Fe (III) aumenta significativamente (Figura 2 (b)). Esto se debe a que [NaH2O]+ se elimina de la estructura de los PBA durante el proceso de tratamiento térmico, y el Fe (II) en los Lw-PBA se oxida parcialmente para mantener el equilibrio de valencia. En el espectro O1s XPS de alta resolución de Hw-PBA, los picos característicos en energías de enlace de 536,0, 533,7, 531,9 y 529,7 eV corresponden a agua intersticial, agua coordinada, grupos hidroxilo superficiales y especies de oxígeno en la red de PBA, respectivamente (Figura 2(c)). Después del tratamiento térmico, el pico característico correspondiente al agua coordinada desaparece, lo que indica que este proceso puede eliminar eficazmente el agua coordinada de los Lw-PBA (Figura 2 (d)). Durante este proceso, el Fe en la superficie de los PBA reacciona con grupos hidroxilo para formar óxidos de hierro, lo que hace que el pico característico de Fe-O con la energía de unión de 530,0 eV mejore considerablemente.
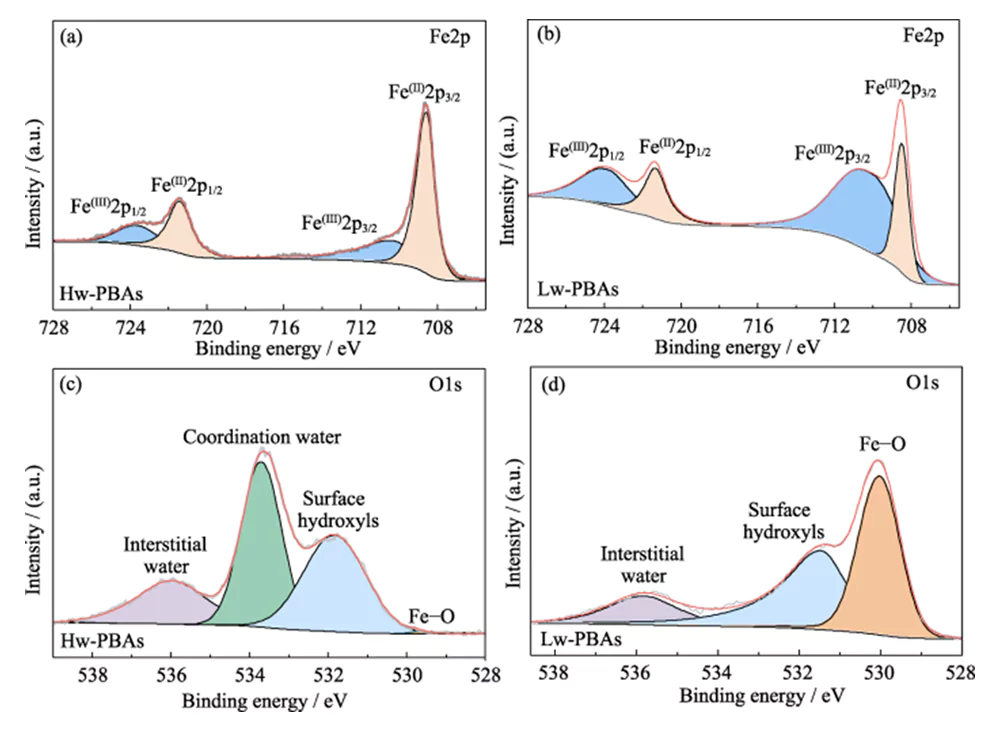
Fig. 2 Composición química del cátodo de PBA
(a, b) espectros Fe2p XPS de (a) Hw-PBA y (b) Lw-PBA; (c, d) espectros XPS de O1s de (c) Hw-PBA y (d) Lw-PBA
2.2 Rendimiento electroquímico
La Figura 3(a) muestra las curvas del ciclo de carga-descarga de corriente constante de medias celdas de iones de sodio con Hw-PBA y Lw-PBA como electrodos positivos a una densidad de corriente de 100 mA·g-1, con una ventana de voltaje de 2,0~ 3,8 V (frente a Na/Na+). Después de 340 ciclos de carga y descarga, el electrodo positivo del Lw-PBA aún puede mantener una alta capacidad específica de 91 mAh·g-1, con una tasa de retención de capacidad del 88% y una tasa promedio de pérdida de capacidad de carga y descarga única de solo 0,035. %, mostrando una excelente estabilidad del ciclo. En las mismas condiciones de carga y descarga, la tasa de retención de capacidad del electrodo positivo de Hw-PBA sin la eliminación de agua cristalina es solo del 73%, lo que muestra el importante papel de eliminar el agua cristalina para mejorar la estabilidad del ciclo del electrodo positivo de PBA. La Figura 3(b) muestra la curva de carga-descarga de corriente constante del cátodo Lw-PBA a una densidad de corriente de 100 mA·g-1, mostrando una característica típica de plataforma de voltaje dual: (1) La plataforma de voltaje de aproximadamente 3,2 V corresponde al proceso redox de Fe2+/Fe3+ de bajo espín (coordinado con C); (2) La plataforma de voltaje de aproximadamente 2,9 V corresponde al proceso redox de Fe2+/Fe3+ de alto espín (coordinado con N). La aparición de una plataforma de voltaje de aproximadamente 3,2 V indica que la eliminación de agua cristalina es beneficiosa para fortalecer la reacción redox del Fe2+/Fe3+ de bajo espín en los PBA, lo que ayuda a mejorar su capacidad de almacenamiento de sodio. En el proceso de ciclo posterior, la curva de carga-descarga del cátodo de Lw-PBA se mantuvo básicamente constante, mostrando una buena estabilidad estructural. A densidades de corriente de 10, 50, 100, 200 y 500 mA·g-1, el cátodo Lw-PBA puede mantener altas capacidades específicas reversibles de 126, 112, 110, 108 y 107 mAh·g-1 (Figura 3). (do)). En particular, a una alta densidad de corriente de 500 mA·g-1, el cátodo Lw-PBA tiene una excelente retención de capacidad y su capacidad específica es aproximadamente un 13,4% mayor que la de los Hw-PBA. Cuando la densidad de corriente vuelve a caer a 10 mA·g-1, la capacidad específica del cátodo Lw-PBA se puede restaurar a 125 mAh·g-1, que está cerca de la capacidad específica inicial, lo que indica que puede mantener una excelente estructura. Estabilidad durante el almacenamiento rápido de sodio.
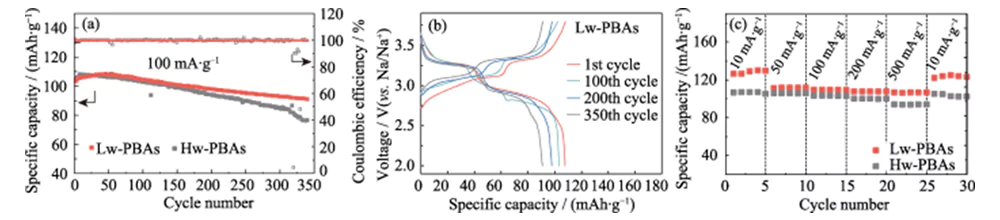
Fig. 3 Rendimiento electroquímico del cátodo de PBA en media celda de ion Na
(a) Rendimiento cíclico de cátodos de Lw-PBA y Hw-PBA a una densidad de corriente de 100 mA·g-1; (b) Curvas de carga-descarga del cátodo de Lw-PBA a 100 mA·g-1; (c) Capacidad de velocidad de los cátodos de Lw-PBA y Hw-PBA a diversas densidades de corriente desde 10 mA·g-1 hasta 500 mA·g-1; La ventana de voltaje es de 2,0 a 3,8 V (frente a Na/Na+) para todas las pruebas de media celda; Figuras coloridas disponibles en el sitio web
2.3 Análisis in situ del mecanismo de almacenamiento de sodio
El electrodo positivo de Lw-PBA se combinó con el electrodo negativo de HC, y se usó una solución DMC/EC que contenía 1,0 mol·L-1 NaClO4 y 5,0% de FEC en masa como electrolito líquido (LE) para ensamblar una batería completa (Lw -PBA|LE|HC, Figura 4(a)). Los cambios estructurales dinámicos de los materiales de los electrodos positivo y negativo de la batería completa durante las reacciones de carga y descarga se estudiaron utilizando tecnología de análisis in situ. El análisis XRD in situ del electrodo positivo Lw-PBA mostró que después de que el voltaje de carga se incrementó a 3,2 V, los picos de difracción correspondientes a (110) y (104) se fusionaron gradualmente para formar un pico amplio (Figura 4(b) ). Este fenómeno corresponde al proceso por el cual el Na+ se escapa del electrodo positivo de Lw-PBA, lo que hace que su estructura cristalina cambie de una estructura trigonal a una estructura cúbica[21]. Durante el proceso de descarga, no se observó una nueva división de este pico amplio en los picos de difracción (110) y (104), lo que indica que el proceso de cambio de fase es irreversible, lo que resulta en la primera pérdida de eficiencia coulómbica. Además, durante el primer proceso de carga y descarga del electrodo negativo de HC, la película de interfase de electrolito sólido (SEI) formada en la superficie conduce a una pérdida irreversible de litio (18%), que es también una de las razones de la primera eficiencia coulómbica. Pérdida de toda la batería (Figura 4 (c, d)).
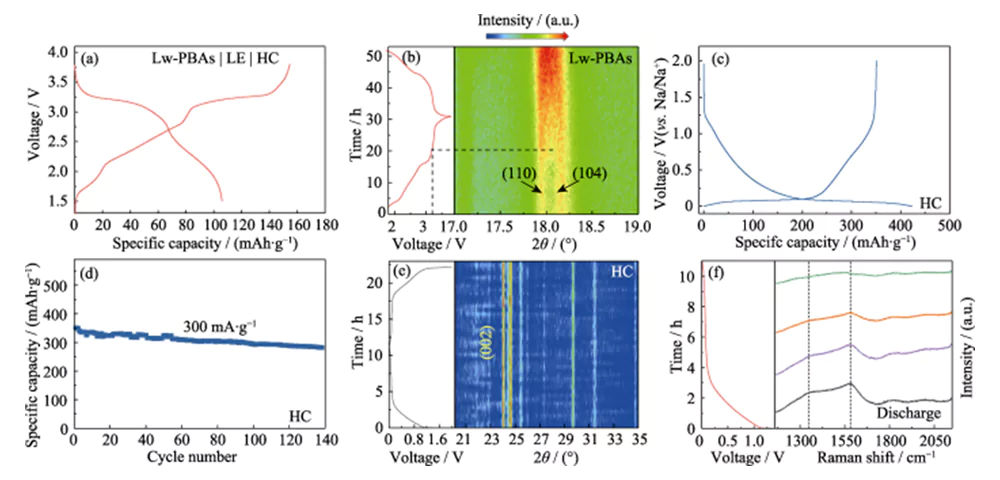
Fig. 4 Análisis in situ del mecanismo de almacenamiento de Na para el cátodo de Lw-PBA y el ánodo de HC
(a) Curvas de carga-descarga de Lw-PBA|LE|HC de celda completa; (b) Patrón de XRD in situ del cátodo de Lw-PBA durante el funcionamiento de la celda completa; (c) Curvas de carga-descarga para el primer ciclo y (d) estabilidad cíclica del ánodo de HC a una densidad de corriente de 300 mA·g-1; (e) Patrón XRD in situ y (f) espectros Raman in situ del ánodo de HC durante el funcionamiento de la celda completa; Figuras coloridas disponibles en el sitio web
En el espectro XRD in situ del ánodo de HC, no se observó ningún cambio de pico obvio (002) durante el proceso de carga y descarga, lo que indica que no se insertó Na+ en las capas de la estructura grafitizada, y no se observaron picos de difracción del sodio metálico ( Figura 4(e)). Por lo tanto, la capacidad de almacenamiento de sodio del ánodo de HC puede deberse a la adsorción y el llenado de Na+ en los sitios ricos en defectos y poros de HC, en lugar de la intercalación de Na+ o la precipitación de sodio metálico [22]. Para estudiar más a fondo el mecanismo de reacción de almacenamiento de sodio en HC, se realizó un análisis Raman in situ en el electrodo negativo de HC durante el proceso de carga y descarga (Figura 4 (f)). El electrodo negativo de HC tiene picos característicos Raman obvios a 1350 y 1594 cm-1. El pico característico con un número de onda de 1350 cm-1 corresponde a la vibración de estiramiento de la configuración del carbono aromático (modo G), y el pico característico con un número de onda de 1594 cm-1 corresponde a la estructura de carbono defectuosa desordenada (modo D). La relación de intensidad del modo D y el modo G (ID/IG) se puede utilizar para medir el grado de defectos y desorden de los materiales de carbono. Durante el proceso de descarga, el ID/IG del ánodo de HC disminuyó con la intercalación continua de Na+, lo que indica que el importante comportamiento de adsorción de Na+ en sus sitios defectuosos es la principal fuente de la capacidad de almacenamiento de sodio del ánodo de HC.
2.4 Construcción y rendimiento de celda completa de estado cuasi sólido
La primera eficiencia coulómbica de la celda completa de iones de sodio construida con un electrodo positivo de Lw-PBA y un electrodo negativo de HC es solo del 67,3% (Figura 4 (a)). Para abordar este problema, se utiliza Na2C2O4, respetuoso con el medio ambiente, poco tóxico y estable al aire, como compensador de sodio autosacrificial en el electrodo positivo de Lw-PBA para mejorar la primera eficiencia coulómbica de la celda completa [23]. El tamaño de partícula del Na2C2O4 comercial es de más de cientos de micrones y tiene poca actividad electroquímica. Por tanto, se recristaliza para obtener Na2C2O4 con un tamaño de partícula de varias micras (Figura 5(a)). El Na2C2O4 del tamaño de una micra puede liberar una alta capacidad específica de 407 mAh·gâ1 durante el primer proceso de carga dentro de la ventana de voltaje de 2,0~4,2 V, compensando eficazmente la primera pérdida de capacidad irreversible del electrodo positivo (Figura 5(b )). La capacidad específica de descarga inicial de la celda completa Lw-PBAs|LE|HC con la adición de Na2C2O4 (fracción de masa 20%) puede alcanzar 158 mAh·g-1, que es un 92,7% mayor que la de la celda completa sin la adición de Na2C2O4 (Figura 5(c)). La celda completa Lw-PBAs|LE|HC con la adición de Na2C2O4 puede mantener una capacidad específica reversible de 110, 101, 92, 87 y 80 mAh·g-1 con densidades de corriente de 10, 50, 100, 200 y 500 mA. ·g-1 (Figura 5(d)). A una alta densidad de corriente de 500 mA·g-1, después de 1400 ciclos estables, la celda completa Lw-PBAs|LE|HC con la adición de Na2C2O4 puede mantener una capacidad específica de 64 mAh·g-1, que es 25,4% mayor que el de la celda completa sin la adición de Na2C2O4 (Figura 5(e)).
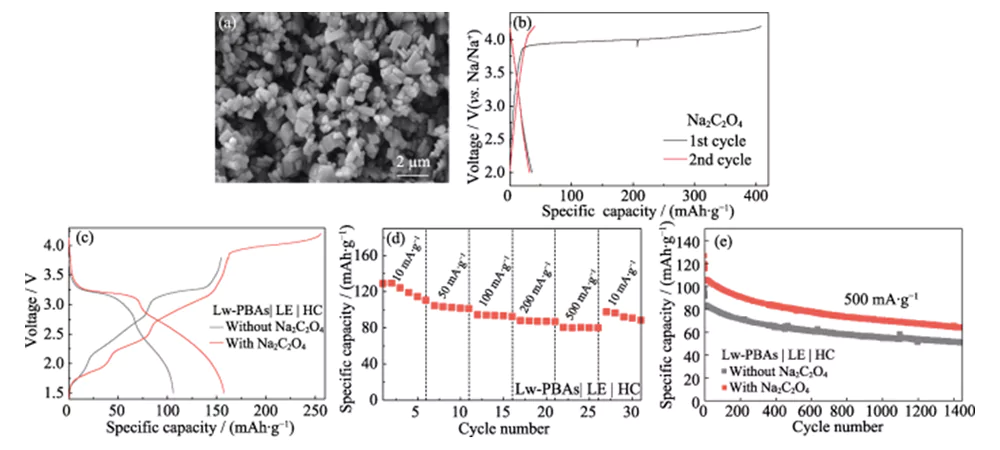
Fig. 5 Efecto del Na2C2O4 sobre el rendimiento electroquímico del cátodo Lw-PBA
(a) imagen SEM y (b) curvas de carga-descarga de Na2C2O4 con tamaño micrométrico a una densidad de corriente de 180 mA·g-1; (c) Curvas de carga-descarga de celdas completas Lw-PBAs|LE|HC con o sin adopción de Na2C2O4 a una densidad de corriente de 100 mA·g-1; (d) Calificar el rendimiento de la celda completa Lw-PBAs|LE|HC con Na2C2O4 a diversas densidades de corriente de 10 a 500 mA·g-1; (e) Estabilidad cíclica de celda completa Lw-PBAs|LE|HC con o sin uso de Na2C2O4 a una gran densidad de corriente de 500 mA·g-1; La ventana de voltaje es de 1,5 a 3,8 V para todas las pruebas de celda completa; Figuras coloridas disponibles en el sitio web
Sobre esta base, se mezcló PEGDA con 1,0 mol·L-1 NaClO4 y electrolito DMC/EC con una fracción de masa de 5,0% FEC, y se utilizó AIBN como iniciador de polimerización térmica para desarrollar un electrolito cuasi sólido de alto rendimiento (GPE ). En comparación con LE, GPE tiene las ventajas de ser menos propenso a fugas y baja volatilidad. Puede permanecer estable a un alto voltaje de 4,9 V (frente a Na/Na+) y tiene una amplia ventana de estabilidad electroquímica (Figura 6(a)). En comparación con los electrolitos sólidos, el GPE tiene una mayor conductividad iónica y compatibilidad de interfaz, y la conductividad iónica a temperatura ambiente es de 3,51 mS·cm-1 (Figura 6(b)). Además, se combinó con el electrodo positivo Lw-PBA de bajo contenido de agua y el electrodo negativo HC para construir una batería completa de iones de sodio de estado casi sólido (Lw-PBA | GPE | HC). Con una densidad de corriente de 100 mA·g-1, la capacidad específica de la primera descarga de la batería de estado cuasi sólido Lw-PBAs|GPE|HC alcanzó 147,8 mAh·g-1 (Figura 6(c)). A densidades de corriente de 20, 50, 100, 200 y 500 mA·g-1, las capacidades específicas se pueden mantener en 105, 94, 82, 70 y 58 mAh·g-1 (Figura 6(d)). Con una densidad de corriente de 100 mA·g-1, se puede realizar ciclos de manera estable más de 200 veces y la eficiencia de Coulombic es cercana al 100 % (Figura 6(e)).
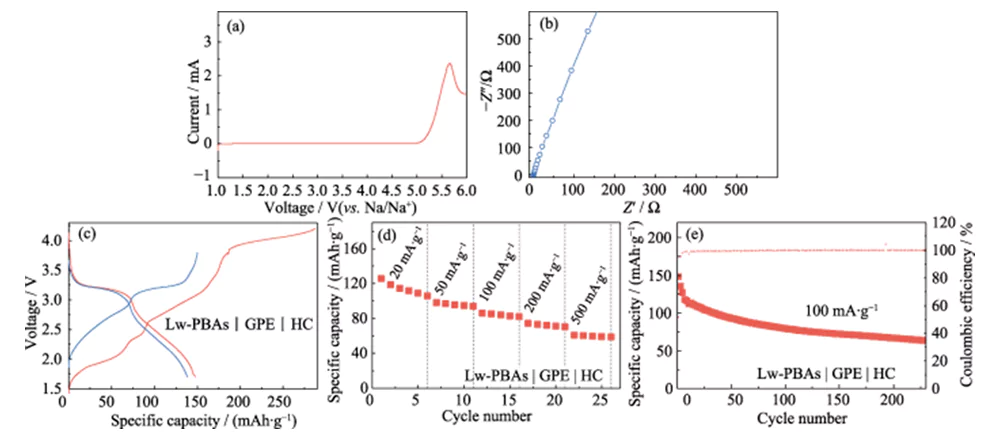
Fig. 6 Rendimiento electroquímico de una celda completa de estado cuasi sólido basada en un cátodo de Lw-PBA y GPE basado en PEGDA
(a) curva LSV a una velocidad de exploración de 5 mV·s-1; (b) espectro EIS; (c) Curvas de carga-descarga a una densidad de corriente de 100 mA·g-1; (d) Tasa de rendimiento a densidades de corriente de 20-500 mA·g-1; (e) Rendimiento de ciclismo a 100 mA·g-1; La ventana de voltaje es de 1,5 a 3,8 V para todas las pruebas de celda completa
3 Conclusión
En este estudio, se prepararon materiales catódicos de PBA con bajo contenido de agua mediante un método de tratamiento térmico simple y eficiente. Se encontró que la eliminación de agua cristalina no solo aumentó la tasa de retención de capacidad del cátodo de PBA del 73 % al 88 % después de 340 ciclos, sino que también ayudó a fortalecer la reacción redox del Fe2+/Fe3+ de bajo espín en los PBA, mejorando así su capacidad de almacenamiento de sodio. El mecanismo dinámico de almacenamiento de sodio del cátodo de PBA y del ánodo de HC fue revelado mediante técnicas Raman in situ y XRD in situ. El análisis mostró que el proceso de escape de Na+ del cátodo de PBA provocó que su estructura cristalina cambiara irreversiblemente de cúbica tridimensional, lo que resultó en la pérdida del primer La eficiencia coulómbica y la adsorción de Na+ en sus sitios defectuosos fueron la principal fuente de la capacidad de almacenamiento de sodio del ánodo de HC. Después de agregar compensador de sodio Na2C2O4 (fracción de masa 20%) al cátodo, la capacidad de primera descarga del cátodo de PBA aumentó en un 92,7%. Sobre la base de la polimerización térmica de PEGDA iniciada por AIBN, se desarrolló un electrolito cuasi sólido de alto rendimiento con una conductividad iónica a temperatura ambiente de 3,51 mS·cm-1 y una ventana de estabilidad electroquímica ampliada a 4,9 V (frente a Na/Na+). Sobre esta base, se integró un cátodo de PBA de bajo contenido de agua con un compensador de sodio Na2C2O4, un ánodo de HC y un electrolito sólido de referencia PEGDA para construir una batería de iones de sodio de estado casi sólido que puede ciclarse de manera estable durante más de 200 veces a una densidad de corriente de 100 mA·g-1. Los estudios han demostrado que la eliminación eficiente del agua cristalina es un medio necesario para mejorar la estabilidad del ciclo del cátodo de PBA y lograr la creación de baterías de iones de sodio de estado cuasi sólido de alto rendimiento.
[1] WANG WL, GANG Y, PENG J, et al. Efecto de la eliminación de agua en el cátodo azul de Prusia para baterías de iones de sodio. Adv. Función. Mater., 2022, 32(25): 2111727.
[2] MENG X Y, LIU Y Z, WANG Z Y, et al. Una celda recargable de estado casi sólido con alta energía y seguridad superior gracias a la química redox estable del Li2S en electrolito de gel. Entorno energético. Ciencia, 2021, 14(4): 2278.
[3] CHE H Y, CHEN S L, XIE Y Y, et al. Estrategias de diseño de electrolitos y avances de la investigación para baterías de iones de sodio a temperatura ambiente. Entorno energético. Ciencia, 2017, 10(5): 1075.
[4] LI W K, ZHAO N, BIZ J, et al. Electrolitos cerámicos Na3Zr2Si2PO12 para batería de iones de Na: preparación mediante el método de secado por aspersión y sus propiedades. J. Inorg. Mater., 2022, 37(2): 189.
[5] LI D, LEI C, LAI H, et al. Avances recientes en la interfaz entre el cátodo y el electrolito sólido de granate para todas las baterías de iones de litio de estado sólido. J. Inorg. Mater., 2019, 34(7): 694.
[6] KIM KJ, BALAISH M, WADAGUCHI M, et al. Baterías de litio-metal de estado sólido: desafíos y horizontes de electrolitos sólidos de óxido y sulfuro y sus interfaces. Adv. Materia energética, 2021, 11(1): 2002689.
[7] GAO H, GUO B, SONG J, et al. Un electrolito compuesto de gel-polímero/fibra de vidrio para baterías de iones de sodio. Adv. Materia energética, 2015, 5(9): 1402235.
[8] LIU Y Z, MENG X Y, SHI Y, et al. Baterías sin ánodo de estado casi sólido de larga duración habilitadas mediante ingeniería de interfaz acoplada con compensación de Li. Adv. Mater., 2023, 35(42): e2305386.
[9] DU G Y, TAO ML, LI J, et al. Batería de iones de sodio de estado sólido duradera, de baja temperatura de funcionamiento y de alta velocidad basada en electrolito de polímero y cátodo azul de Prusia. Adv. Materia energética, 2020, 10(5): 1903351.
[10] PENG J, ZHANG W, LIU Q N, et al. Análogos del azul de Prusia para baterías de iones de sodio: pasado, presente y futuro. Adv. Mater., 2022, 34(15): 2108384.
[11] LU Y H, WANG L, CHENG J G, et al. Azul de Prusia: un nuevo marco de materiales de electrodos para baterías de sodio. Química. Comunitario, 2012, 48(52): 6544.
[12] SÃNGELAND C, MOGENSEN R, BRANDELL D, et al. Ciclos estables de baterías de estado sólido de metal sodio con electrolitos poliméricos a base de policarbonato. Aplicación ACS. Escuela politécnica. Mater., 2019, 1(4): 825.
[13] KIM T, AHN S H, SONG Y Y, et al. Electrolitos sólidos conductores de iones de sodio de tipo azul de Prusia para todas las baterías de estado sólido. Angélica. Química. Int. Ed., 2023, 62(42): e202309852.
[14] SONG J, WANG L, LU Y H, et al. Eliminación de H2O intersticial en hexacianometalatos para un cátodo superior de una batería de iones de sodio. J. Am. Química. Soc., 2015, 137(7): 2658.
[15] LIU Y, FAN S, GAO Y, et al. Síntesis isoestructural de análogos del azul de Prusia a base de hierro para baterías de iones de sodio. Pequeño, 2023, 19(43): e2302687.
[16] WANG W, GANG Y, HU Z, et al. Evolución estructural reversible del azul de Prusia romboédrico rico en sodio para baterías de iones de sodio. Nat. Comunitario, 2020, 11: 980.
[17] USTED Y, YU X Q, YIN Y X, et al. Hexacianoferrato de hierro y sodio con alto contenido de Na como material catódico rico en Na para baterías de iones de Na. Nano Res., 2014, 8(1): 117.
[18] REN W H, QIN M S, ZHU Z X, et al. Activación de los sitios de almacenamiento de sodio en análogos del azul de Prusia mediante grabado superficial. Nano Lett., 2017, 17(8): 4713.
[19] ZHANG H, GAO Y, PENG J, et al. Análogos del azul de Prusia con orientación optimizada del plano del cristal y bajos defectos del cristal hacia baterías de iones alcalinos de 450 Wh·kgâ1. Angélica. Química. Int. Ed., 2023, 62(27): e202303953.
[20] ZHANG Z H, AVDEEV M, CHEN H C, et al. Análogos litiados del azul de Prusia como materiales activos de electrodos positivos para baterías estables de iones de litio no acuosas. Nat. Comuni., 2022, 13: 7790.
[21] JIANG M, HOU Z, MA H, et al. Resolver la desactivación de sitios de Fe de bajo espín mediante la redistribución de la densidad de electrones hacia el almacenamiento de sodio de alta energía. Nano Lett., 2023, 23(22): 10423.
[22] TANG Z, ZHANG R, WANG H Y, et al. Revelando la formación de poros cerrados del carbón duro derivado de la madera residual para baterías avanzadas de iones de sodio. Nat. Comuni., 2023, 14: 6024.
[23] NIU Y B, GUO Y J, YIN Y X, et al. Compensación de sodio catódico de alta eficiencia para baterías de iones de sodio. Adv. Mater., 2020, 32(33): e2001419.





