Actividad electroquímica del electrodo positivo Material de la batería de iones de sodio P2-Nax[Mg0.33Mn0.67]O2
Autor: ZHANG Xiaojun1, LI Jiale1,2, QIU Wujie2,3, YANG Miaosen1, LIU Jianjun2,3,4
1. Centro de ciencia y tecnología de la provincia de Jilin para la conversión limpia y la utilización de biomasa de alto valor, Universidad de Energía Eléctrica del Noreste, Jilin 132012, China
2. Laboratorio estatal clave de cerámica de alto rendimiento y microestructura superfina, Instituto de Cerámica de Shanghai, Academia de Ciencias de China, Shanghai 200050, China
3. Centro de Ciencia de Materiales e Ingeniería Optoelectrónica, Universidad de la Academia de Ciencias de China, Beijing 100049, China
4. Escuela de Química y Ciencia de Materiales, Instituto de Estudios Avanzados de Hangzhou, Universidad de la Academia de Ciencias de China, Hangzhou 310024, China
Resumen
Con las ventajas de bajo costo y amplia distribución de materias primas, Las baterías de iones de sodio se consideran los mejores materiales alternativos para Materiales del cátodo de batería de iones de litio. En la fase P2 NaMnO2 con capas estructura, la solución sólida binaria de la capa de metal de transición puede efectivamente mejorar el rendimiento electroquímico del material del electrodo. en esto estudio, el modelo estructural de Nax[Mg0.33Mn0.67]O2 con ion Mg La solución sólida se construyó utilizando el modelo de Coulombic. El Los cálculos de primeros principios revelaron que el voltaje de descarga de Nax[Mg0.33Mn0.67]O2 alcanzó 3,0 V a una Contenido de iones de sodio inferior a 0,67. Densidad electrónica de estados y carga. El análisis poblacional mostró que la solución sólida de Mg motivó el proceso aniónico. actividad electroquímica del oxígeno reticular en la fase P2 Nax[Mg0.33Mn0.67]O2, que transformó El mecanismo de reacción electroquímica del sistema de catiónico y aniónico. reacción redox sinérgica a reacción redox aniónica reversible. Este La transformación proporciona un método novedoso para el diseño de materiales de electrodos. para baterías de iones de Na, así como un nuevo enfoque para la optimización y exploración de otras baterías de iones.
Palabras claveï¼ batería de iones de sodio ; electroquímico actividad ; primer principio; dopaje con metales alcalinos
TOB NEW ENERGY proporciona un conjunto completo de materiales para baterías, máquina de baterías, solución de línea de producción de baterías y tecnología de baterías para baterías de estado sólido, Fabricación de baterías de iones de sodio y baterías de iones de litio.
Berthelot et al.[10] encontraron que en el óxido en capas NaTMO2 que contiene un único metal de transición (TM), sodio Los iones y las vacantes están ordenados en la capa de sodio puro, lo que resulta en muchos plataformas de voltaje para este tipo de óxido durante el proceso de descarga. . Este produce una rápida disminución de la capacidad específica y una reducción significativa de rendimiento del ciclo, por lo que la eficiencia de conversión de energía de este tipo de óxido es bajo. Los elementos de solución sólida se introducen en la capa de metal de transición para Forman una disposición mixta de metales de transición binarios o incluso de múltiples elementos. El El material del electrodo contiene una gran cantidad de cargas desordenadas, que pueden suprime eficazmente la plataforma de voltaje anterior y mejora la conversión de energía eficiencia. Yabuuchi et al.[11]usaron Na2CO3, (MgCO3)4Mg(OH)2·5H2O y MnCO3 como materias primas. Se llevó a cabo una reacción en estado sólido a 900°C durante 12 horas para obtener un electrodo de Na2/3[Mg1/3Mn2/3]O2 de fase P2 binaria desordenada material con solución sólida de Mg. Descubrieron que con una densidad de corriente de 10 mA/g, la capacidad específica inicial de la fase P2 preparada El material del cátodo Na2/3[Mg1/3Mn2/3]O2 era de aproximadamente 150 mAh/g[11]. Levemente inferior a la capacidad específica de Na2/3MnO2 (184 mAh/g). Bruce et al. [12] descubrieron que, aunque había una reacción electroquímica de red oxígeno en la fase P2 Na2/3[Mg1/3Mn2/3]O2, no se produjo precipitación de oxígeno. observado. Se demuestra que la introducción de Mg mejora la reversibilidad del ciclo. y capacidad específica reversible del material. Sin embargo, durante la carga y proceso de descarga, el mecanismo de reacción electroquímica microscópica de El oxígeno reticular en este sistema aún no está claro, y el mecanismo por el cual Tampoco está claro que la solución sólida de magnesio mejore la estabilidad del sistema.
Por lo tanto, este trabajo toma la fase P2. Nax[Mg0.33Mn0.67]O2 como objeto de investigación y adopta los primeros principios Método de cálculo de la teoría funcional de la densidad (DFT). Un estudio sistemático sobre la actividad electroquímica y la estabilidad estructural de la descarga. Rendimiento del material del cátodo Nax[Mg0.33Mn0.67]O2 con solución sólida de Mg Se realizó iones. Para aclarar el mecanismo microscópico del electrodo. materiales en reacciones electroquímicas a microescala de electrones y átomos, proporcionará una referencia para la comprensión de la electroquímica. procesos y el diseño de nuevos materiales.
1 Método de cálculo
Los cálculos de este trabajo se basan en el paquete VASP de software de base de onda plana [13,14] de densidad Teoría funcional. Se utiliza el método de onda plana aditiva[15], y la función de correlación de intercambio es la aproximación de gradiente generalizada (GGA) en forma de Perdew-Burker-Ernzerhof[13,16]. El Hubbard Se introduce el parámetro U para corregir los electrones d de Mn, y el U efectivo. El valor es 3,9 eV [17,18]. La energía de corte de la onda del plano inferior. es de 600 eV. Cuando se completa la relajación de los iones, las fuerzas sobre todos los átomos son menores. superior a 0,1 eV·nm-1. Al optimizar la estructura cristalina, un 3Ã3Ã1 (72 átomos) Se utiliza estructura de supercélula, la constante de red es 0,874 nmÃ0,874 nmÃ1,056 nm, y la cuadrícula de puntos k de la zona de Brillouin es 3Ã3Ã 3[19]. El Se utilizó el método del fonón congelado para calcular el espectro de vibración de la red en el paquete de software Phonopy. Para evitar la influencia de periódicos condiciones de contorno, se utilizó una estructura de supercélula de 3×3×1 para calcular la constantes de fuerza y espectros de fonones de la fase P2 NaMnO2 y Na[Mg0.33Mn0.67]O2. El modelo de Coulomb de carga puntual se utiliza para calcular rápidamente la ocupación de iones. de la estructura de sodio, y la configuración de ocupación de Na con la más baja La energía de Coulomb se selecciona para realizar cálculos de primeros principios más precisos[20]. El voltaje de descarga del material del electrodo se puede expresar como[20]:
$V=-\frac{G(\text{N}{{\text{a}}_{{{x}_{2}}}}\text{M}{{\text{O} }_{2}})-G(\text{N}{{\text{a}}_{{{x}_ {1}}}}\text{M}{{\text{O}}_{2}})-({{x}_{2}}-{{x}_{1}})G(\ texto{Na})}{({{x}_{2}}-{{x}_{1}}){{e}^{-}}}$
Donde G es la energía total del sistema correspondiente, y e- es la carga del elemento[21].
2 Resultados y discusión
2.1 Características microestructurales y estabilidad estructural
El grupo espacial de la fase P2 NaMnO2. La estructura es R$\bar{3}m (Fig. 1)[22,23]. La configuración espacial de la solución sólida de Mg Na0.67[Mg0.33Mn0.67]O2 la estructura es similar a la de NaMnO2. Los iones de Mg reemplazan 1/3 de los iones de Mn en la capa de metal de transición. El La relación teórica de iones de Mg a Mn es 1:2. Caracterización experimental encontrada. que en esta relación, los iones de Mg en la estructura Nax[Mg0.33Mn0.67]O2 solo forman arreglos desordenados con Mn, conservando el orden de la capa de Na[24]. Cuando la proporción de iones Mg:Mn1:2, Mg, Na y Mn formarán una mezcla desordenada. disposición de cationes. Como se muestra en la Figura 1 (A), el modo de apilamiento de la celosía el oxígeno es ABBA..., Mg y Mn ocupan respectivamente los sitios octaédricos entre las capas de oxígeno AB, y Na ocupa los sitios del prisma triangular entre las capas de oxígeno AA y BB [25,26]. Como se muestra en la Figura 1(B), hay una disposición en forma de panal de Mg y Mn en la capa de metal de transición[27], que es similar a la disposición entre Li y Mn en compuestos ricos en litio [28]. El octaedro [MgO6] está organizado con 6 octaedros [MnO6] que comparten bordes[29,30]. En la capa de metal alcalino del Estructura Na0,67[Mg0,33Mn0,67]O2, hay dos sitios reticulares para los iones de sodio. Uno está dispuesto con las capas superior e inferior de octaedros [MgO6] o [MnO6] compartiendo bordes. El otro está dispuesto coplanarmente con las capas superior e inferior de Octaedros de [MgO6] o [MnO6].
![Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2 Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2](/js/htmledit/kindeditor/attached/20231108/20231108103040_37156.webp)
Fig. 1 Diagrama esquemático de P2-Na2/3[Mg1/3Mn2/3]O2
En estructuras con diferentes iones de sodio. contenido, los iones de sodio se ven afectados por la interacción de Coulomb entre Mn y Mg en la capa de metal de transición e iones Na en la capa de metal alcalino, mostrando Dos modos de ocupación diferentes. Por lo tanto, este trabajo utiliza primero el Coulomb. modelo para descartar rápidamente la configuración de Na0.67[Mg0.33Mn0.67]O2 de la fase P2 con la energía de Coulomb más baja. Para verificar la racionalidad, calculó y simuló los patrones XRD de estas configuraciones seleccionadas y los comparó con los resultados medidos[11]. Los resultados se muestran en la Figura 2. Los cálculos (016) y (110) están ligeramente desplazados hacia la derecha en comparación con la caracterización experimental, que se debe principalmente a la existencia de estructuras amorfas y defectuosas en algunos planos cristalinos del Materiales preparados experimentalmente. La estructura del modelo computacional es una estructura cristalina perfecta, por lo que hay una cierta desviación entre el XRD ampliación e intensidad máxima de la simulación computacional y la resultados experimentales. Además, hay una disposición de iones Na en estos dos planos cristalinos, y la inserción y desprendimiento de iones Na es otro posible motivo del cambio de las posiciones de pico correspondientes. Después Considerando los efectos anteriores, la forma del pico y la intensidad de la simulación XRD son consistentes con los resultados experimentales y el modelo construido puede reproducir la información microestructural en el experimento, indicando que la estructura teóricamente seleccionada es relativamente precisa y confiable[31,32].
![Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2 Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103050_54123.webp)
Fig. 2 Comparaciónn de XRD calculado y experimental patrones de Na0,67[Mg0,33Mn0,67]O2
Para estudiar el efecto del Mg sólido solución sobre estabilidad estructural, utilizamos primeros principios combinados con los "método del fonón congelado" para calcular los espectros de vibración reticular de P2-NaMnO2 y P2-Na[Mg0,33Mn0,67]O2. Como se muestra en la Figura 3, la onda poseedora no tiene frecuencia imaginaria en toda la zona de Brillouin, lo que indica que P2-Na[Mg0.33Mn0.67]O2 tiene estabilidad dinámica. Comparando los espectros de fonones de los dos materiales, se encontró que el dopaje con Mg no cambió significativamente la rango de frecuencia de vibración y tuvo poco impacto en la vibración de la red. El La estructura dopada con Mg también mostró una buena estabilidad dinámica. Además, Bruce y Alabama. preparó con éxito la fase P2 Na[Mg0.33Mn0.67]O2 con solución sólida de Mg, lo que demostró además que el material tiene termodinámica adicional estabilidad. Por lo tanto, no es difícil ver que P2-Na[Mg0.33Mn0.67]O2 tiene buena estabilidad estructural.
![Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2 Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103102_42296.webp)
Fig. 3 Curvas de dispersión de fonones de (A) NaMnO2 y (B) Na0,67[Mg0,33Mn0,67]O2
2.2 Análisis de propiedades electroquímicas de fase P2 Nax[Mg1/3Mn2/3]O2
Para estudiar el efecto del dopaje con Mg Sobre las propiedades electroquímicas de los materiales, calculamos la descarga. voltaje de la estructura de solución sólida de Mg P2-Nax[Mg0.33Mn0.67]O2 (Figura 4). El El rango de concentración de iones Na se determina experimentalmente, es decir, 0,11â¤xâ¤0,66[11].La Figura 4(A) muestra los cambios estructurales durante el proceso de descarga, y su voltaje correspondiente (Figura 4 (B)) incluye principalmente tres plataformas: 3,4, 2,9 y 2,1 V. La capacidad teórica prevista es 152 mAh/g, lo que es básicamente consistente con los resultados experimentales[11]. La curva de voltaje de descarga calculada a partir de los primeros principios es ligeramente mayor que el resultado medido real. La razón principal es que la primera El cálculo de principios ignora la influencia de la medición experimental. Condiciones, como electrolito, conductividad de iones de litio experimental. temperatura de medición, etc. Nuestra investigación anterior mostró [33] que aunque la curva de voltaje de descarga calculada es mayor que la curva medida experimentalmente, la tendencia de cambio general es consistente. Por lo tanto, se puede considerar que durante todo el proceso de alta, el El voltaje de Nax[Mg0.33Mn0.67]O2 es consistente con los resultados experimentales[12,20]. Cuando x<66%, Nax[Mg0.33Mn0.67]O2 tiene un alto voltaje de aproximadamente 3.0 V, y no hay una plataforma de voltaje adicional obvia, lo que indica que la sustitución de Mg2+ por Mn3+ tiene el efecto de inhibir el reordenamiento de iones de sodio y cambio de fase estructural. Estudios anteriores de carga y descarga sobre NaMnO2 y otros sistemas han encontrado que la disposición ordenada de los metales de transición suele ir acompañada de más plataformas de voltaje.
![Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge](/js/htmledit/kindeditor/attached/20231108/20231108103110_90088.webp)
Fig. 4 (A) cambios estructurales calculados por DFT y (B) Curva de voltaje de descarga de P2-Nax[Mg0.33Mn0.67]O2 durante la descarga
En circunstancias ideales, la valencia los estados de Mg y Mn en Na2/3[Mg0.33Mn0.67]O2 son +2 y +4 respectivamente, y no puede continuar oxidándose a estados de valencia superiores. Por lo tanto, no hay actividad electroquímica catiónica en el sistema, y la carga y descarga El proceso del material es una reacción electroquímica aniónica. En Na0,67MnO2, El estado de valencia inicial de los iones Mn es +3,33. Durante el proceso de carga, Mn Los iones pueden transferir 0,67 electrones hacia afuera para alcanzar una valencia estable de +4. En Esta vez, todo el Na+ ha sido liberado y el oxígeno reticular nunca ha desaparecido. participó en la reacción electroquímica[34]. Por lo tanto, el El proceso de carga y descarga de Na0.67MnO2 aparece como un catiónico. reacción electroquímica. Muchos estudios han demostrado que cuando el número de electrones perdidos por el oxígeno reticular es inferior a 0,33, el valor electroquímico aniónico La reacción tiene buena reversibilidad [11-12,28]. La oxidación excesiva de aniones de oxígeno (el número de electrones perdidos es superior a 0,33) provoca la configuración electrónica del oxígeno para desviarse del stregla capaz de ocho acopladores, resultando en una reacción de transformación irreversible y la formación de un Vínculo OO. Incluso puede provocar desprendimiento de oxígeno y carga irreversible y descarga de la estructura del electrodo [27,35]. En Na0,67[Mg0,33Mn0,67]O2, si se considera el estado límite de pérdida de carga. Eso es decir, cuando los iones Na se desprenden completamente para formar Na0[Mg0.33Mn0.67]O2 estructura, Mg y Mn siempre mantienen valencias +2 y +4. El anión O es oxidado a -1,67 de valencia, perdiendo 0,33 electrones, que es inferior al límite de reacción electroquímica aniónica irreversible. Por lo tanto, en toda creacción de carga de Na0.67[Mg0.33Mn0.67]O2, el oxígeno de la red no necesita reorganizarse espacialmente y la reacción electroquímica es reversible. La introducción de Mg2+ no sólo mantiene la capacidad específica reversible, pero también aumenta la densidad de energía del material al aumentar la voltaje de descarga.
Para demostrar la electroquímica. Actividad del oxígeno en el material Nax[Mg0.33Mn0.67]O2 durante la descarga. proceso, calculamos la densidad electrónica de estados (Figura 5) para el Estructuras de descarga inicial y final del material. Se encontró que Durante el proceso de descarga, los iones de Na se incorporaron gradualmente, el número total La cantidad de electrones en el sistema aumentó y el nivel de Fermi pasó a un nivel más alto. nivel de energía. El número de agujeros en la órbita O2p disminuye gradualmente, indicando que los electrones que ingresan al sistema se transfieren al vacío órbitas del oxígeno reticular, y el oxígeno reticular se reduce. durante el proceso de descarga del material del electrodo, el oxígeno de la red participa en La reacción electroquímica de los aniones. En este momento casi no hay cambios. en los electrones orbitales Mn-d, y no hay transferencia de carga, es decir, la El estado de valencia del Mn no cambia durante el proceso de descarga, lo que demuestra que El Mn no es electroquímicamente activo[12,36]. Sin embargo, durante el proceso de descarga de P2-NaxMnO2, los electrones continúan llenando el Mn de alta energía y O orbitales vacíos, lo que indica que tanto Mn como O son electroquímicamente activos y son una reacción electroquímica típica en la que cooperan aniones y cationes.
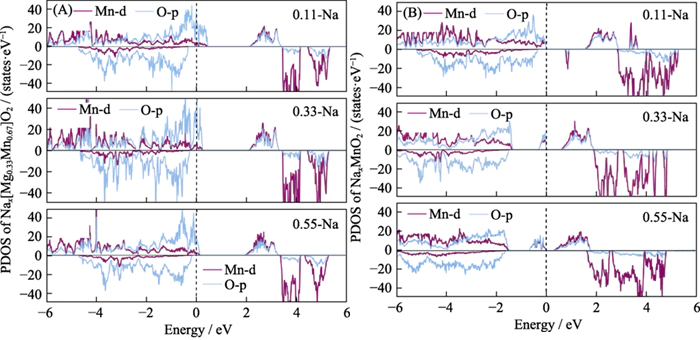
Fig. 5 Densidad electrónica de estados de (A) P2-Nax[Mg0.33Mn0.67]O2 y (B) P2-NaxMnO2 bajo diferentes iones Na contenido durante el alta
PDOS: proyectado densidad de estados
Se puede sacar una conclusión coherente a través del análisis de la población de cargos (Figura 6). Durante el proceso de alta de Nax[Mg0.33Mn0.67]O2, la cantidad de carga de los iones Mn básicamente no cambia, por lo que no participa en la reacción electroquímica; en vías de Al aumentar el contenido de Na de 0,11 a 0,66, los iones O obtuvieron aproximadamente 0,2e-. Se produjo un llenado de carga significativo, que muestra actividad electroquímica aniónica [37]. Mediante el análisis de la población de carga de P2-NaxMnO2, se encontró que a medida que aumenta el contenido de Na, Mn y O participan conjuntamente en la reacción electroquímica. Este resultado es consistente con el análisis de densidad electrónica de estados. Se demuestra que la solución sólida de Mg cambia el mecanismo de reacción electroquímica del sistema de anión y reacción electroquímica cooperativa de cationes a un anión reversible reacción electroquímica, y este proceso no afecta la carga y reversibilidad de descarga del material.
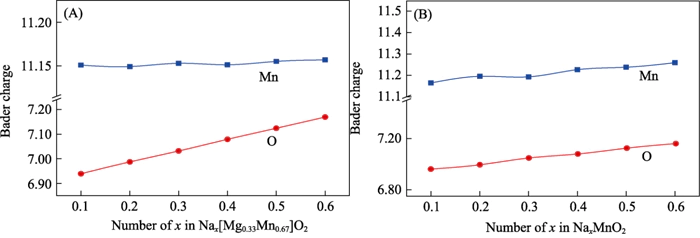
Fig. 6 Cargar análisis de (A) Nax[Mg0.33Mn0.67]O2 y (B) P2-NaxMnO2 bajo diferentes iones de sodio contenido
3 Conclusión
Este estudio utilizó primeros principios cálculos para estudiar sistemáticamente las características microestructurales, Estabilidad cinética y actividad electroquímica de la solución sólida P2 de Mg2+. fase Nax[Mg1/3Mn2/3]O2. La introducción de Mg2+ cambia el estado electroquímico. Tipo de reacción del material de la cooperativa aniónica y catiónica. Reacción electroquímica de NaxMnO2 al electroquímico aniónico reversible. reacción de Nax[Mg0.33Mn0.67]O2. Cuando el anión O en P2-Nax[Mg0.33Mn0.67]O2 participa en la reacción electroquímica, el rango de ganancia y pérdida de carga es Menos de 0,33, lo que tiene buena reversibilidad. La introducción del Mg2+ no sólo aumenta el voltaje de descarga del material, pero también mantiene la capacidad específica reversible del material y, en última instancia, aumenta la densidad de energía del material.
En materiales de electrodos de iones de sodio, introducción de metales alcalinotérreos en la transición metcapa al para catiónico La solución sólida es una nueva estrategia de optimización del rendimiento del material. es basico El mecanismo es desencadenar la actividad electroquímica de los aniones sacrificando la actividad electroquímica de los cationes, cambiando la reacción electroquímica mecanismo del material, aumentando el voltaje de descarga y, en última instancia, optimizando la densidad energética del material. Esta estrategia no sólo proporciona un nuevo método para el diseño de materiales de electrodos para baterías de iones de sodio, pero también proporciona nuevas ideas para la optimización y exploración de otros iones. baterías.
Referencias
[1] HU YING-YING, WEN ZHAO-YIN, RUI-KUN, et Alabama. Lo último Estado de investigación y desarrollo de baterías de sodio. Almacenamiento de energía Ciencia y Tecnología, 2013,2(2):81-90.
[2] SHEN GUAN-YE, LI CHEN, XU BING-LIANG, et Alabama. Asignación económica para sistema de almacenamiento de energía considerando la energía eólica. Diario del noreste Universidad de Energía Eléctrica, 2018,38(4):27-34.
[3] MA CHAO, ZHAO XIAO-LIN, KANG LI-TAO, et Alabama. No conjugado Materiales anódicos de dicarboxilato para celdas electroquímicas. Angélica. Química. Int. Ed., 2018,57(29):8865-8870.
[4] RICARDO W D, DACEK S T, KITCHAEV D A, et al. fluoración de Materiales catódicos de óxido de metal de transición con exceso de litio. Energía Avanzada Materiales, 2018,8(5):1701533.
[5] XIANG XING-DE, ZHANG KAI, CHEN JUN. Avances recientes y Perspectivas de materiales catódicos para baterías de iones de sodio. Adv. Mater., 2015,27(36):5343-5364.
[6] MA CHAO, ZHAO XIAO-LIN, HARRIS M M, et al. El ácido úrico como Compuesto electroquímicamente activo para baterías de iones de sodio: mecanismos de almacenamiento gradual de Na+ de conjugación Ï y anión de carbono estabilizado. Materiales aplicados ACS & Interfaces, 2017,9(39):33934-33940.
[7] SOTAVENTO D H, XU JING, MENG Y S. Un cátodo avanzado para baterías de iones de Na con alta velocidad y excelente estabilidad estructural. Física. Química. Química. Phys., 2013,15(9):3304-3312.
[8] KUBOTA K, YABUUCHI N, YOSHIDA H, et Alabama. Óxidos en capas como Materiales de electrodos positivos para baterías de iones de Na. Boletín MRS, 2014,39(5):416-422.
[9] CLÉMENT R J, BRUCE P G, GREY C P. Revisión: manganeso- Óxidos de metales de transición de tipo P2 a base de materiales catódicos de baterías de iones de sodio. Diario de la Sociedad Electroquímica, 2015,162(14):A2589-A2604.
[10] BERTHELOT R, CARLIER D, DELMAS C. Electroquímica Investigación del diagrama de fases de P2-NaxCoO2. Nat. Mater., 2011,10(1):74-80.
[11] YABUUCHI N, HARA R, KUBOTA K, et Alabama. Un nuevo electrodo Material para baterías de sodio recargables: Na2/3[Mg0.28Mn0.72]O2 tipo P2 con niveles anormalmente altos. Capacidad reversible. J. Mater. Química. A, 2014,2(40):16851-16855.
[12] MAITRA U, CASA R A, SOMERVILLE J W, et al. Redox de oxígeno química sin exceso de iones de metales alcalinos en Na2/3[Mg0.28Mn0.72]O2. Nat. Química, 2018,10(3):288-295.
[13] GUO SHAO-HUA, SUN YANG, YI JIN, et Alabama. Comprensión Difusión de iones de sodio en óxidos P2 y P3 en capas mediante experimentos. y cálculos de primeros principios: un puente entre la estructura cristalina y rendimiento electroquímico. Materiales de NPG Asia, 2016,8:e266.
[14] JI HUI-WEI, KITCHAEV D A, LUN ZHANG-YAN, et al. computacional Investigación y realización experimental de iones de litio desordenados de alta capacidad. cátodos basados en Ni redox. química de Materiales, 2019,31(7):2431-2442.
[15] LEE J, URBAN A, LI XIN, et Alabama. Desbloqueando el Potencial de óxidos catiónicos desordenados para baterías de litio recargables. Ciencia, 2014,343(6170):519-522.
[16] URBAN A, LEE J, CEDER G. La configuración espacio de óxidos tipo sal gema para electrodos de baterías de litio de alta capacidad. Energía Avanzada Materiales, 2014,4(13):1400478.
[17] CHAKRABORTY A, DIXIT M, AURBACH D, et Alabama. Predecir con precisión Propiedades catódicas de materiales de óxido en capas utilizando la densidad SCAN meta-GGA. funcional. npj computacional Materiales, 2018,4:60.
[18] URBAN A, ABDELLAHI A, DACEK S, et Alabama. estructura electrónica Origen del desorden catiónico en óxidos de metales de transición. Física. Rev. Lett., 2017,119(17):176402.
[19] ASSAT G, TARASCON J M. Fundamental Comprensión y desafíos prácticos de la actividad redox aniónica en Li-ion. baterías. Energía de la naturaleza, 2018,3(5):373-386.
[20] YABUUCHI N, NAKAYAMA M, TAKEUCHI M, et Alabama. origen de Estabilización y desestabilización en reacción redox en estado sólido de iones óxido. para baterías de iones de litio. Nat. Comunitario, 2016,7:13814.
[21] SANNYAL A, AHN Y, JANG J. Primeros principios estudio sobre el siligeno bidimensional (2D SiGe) como material anódico de un Batería de iones de metal alcalino. computacional Ciencia de los Materiales, 2019,165:121-128.
[22] LI HONG, HU YONG-SHENG, PAN HUI-LIN, et Alabama. Avances de la investigación sobre Estructura del material del electrodo de una batería de almacenamiento de iones de sodio a temperatura ambiente. Ciencia sínica Chimica, 2014,44(8):1269-1279.
[23] WANG YUE-SHENG, XIAO RUI-JUAN, HU YONG-SHENG, et Alabama. Electrodo desordenado de cationes P2-Na0.6[Cr0.6Ti0.4]O2 para baterías de iones de sodio recargables simétricas de alta velocidad. Nat. Comunitario, 2015,6:6954.
[24] WANG QIN-CHAO, MENG JING-KE, YUE XIN-YANG, et Alabama. Tuning estructurado P2 material del cátodo mediante sustitución de Na-site Mg para baterías de iones de Na. J. Am. Química. Soc., 2019,141(2):840-848.
[25] MENDIBOURD A, DELMAS C, HAGENMULLER C. Electroquímicos Intercalación y desintercalación de bronces NaxMnO2. Prensa académica, 1985, 57(3):323-331.
[26] SOMERVILLE J W, SOBKOWIAK A, TAPIA-RUIZ N, et al. naturaleza de la Fase Z en cátodos de baterías de iones de Na en capas. Energía & Ciencias Ambientales, 2019,12(7):2223-2232.
[27] QU JIE, WANG DONG, YANG ZU-GUANG, et Alabama. Dopaje iónico Ajuste del cátodo compuesto inducido por variación del sitio: un estudio de caso de capa-túnel Na0.6MnO2 con dopaje con Mg2+ en el sitio Na/Mn. Aplicación ACS. Madre. Interfaces, 2019,11(30):26938-26945.
[28] SATO T, SATO K, ZHAO WEN-WEN, et Alabama. Metaestable y Óxidos de sal rocosa desordenados con cationes de tamaño nanométrico: revisión de la estequiometría LiMnO2 y NaMnO2. Diario de materiales Química A, 2018,6(28):13943-13951.
[29] GUIGNARD M, DELMAS C. Usando una batería para sintetizar nuevos óxidos de vanadio. Selección de química, 2017,2(20):5800-5804.
[30] WANG PENG-FEI, YAO HU-RONG, LIU XIN-YU, , et al. El desorden de Na+/vacantes promete baterías de iones de Na de alta velocidad. Avances científicos, 2018, 4(3): eaar6018.
[31] KIM H, KIM D J, SEO D H, et al. Estudio ab initio de la intercalación de sodio y fases intermedias en Na0,44MnO2 para batería de iones de sodio. química de Materiales, 2012,24(6):1205-1211.
[32] LI XIN, MA XIAO-HUA, SU DONG, et Alabama. visualización directa del efecto Jahn-Teller acoplado al ordenamiento del Na en Na5/8MnO2. Nat. Mater., 2014,13(6):586-592.
[33] WANG YOUWEI, WANG JUNKAI, ZHAO XIAOLIN, et Alabama. Reduciendo la carga Sobrepotencial de las baterías de Li-O2 mediante el diseño de cátodos con alineación de banda. Energía & Ciencias Ambientales, 2020,13(8):2540-2548.
[34] ZHENG C, RADHAKRISHNAN B, CHU I H, et al. Efectos de Mezcla de metales de transición sobre el ordenamiento del Na y la cinética de los óxidos de P2 en capas. Revisión física Aplicado, 2017,7(6):064003.
[35] LUN ZHENG-YAN, OUYANG B, CAI ZI-JIAN, et Alabama. Principios de diseño para Cátodos de sal gema desordenada con cationes a base de Mn de alta capacidad. Química, 2020,6(1):153-168.
[36] SEO D H, LEE J, URBAN A, et al. Los estructurales y origen químico de la actividad redox del oxígeno en capas y cationes desordenadas. Materiales catódicos con exceso de Li. Nat. Química, 2016,8(7):692-697.
[37] BAI QIANG, YANG LU-FENG, CHEN HAI-LONG, et Alabama. Estudios computacionales de materiales de electrodos en baterías de iones de sodio. Energía Avanzada Materiales, 2018,8(17):1702998.