Preparación de nanocubos de Fe4[Fe(CN)6]3 de alta calidad: como material de cátodo para baterías acuosas de iones de sodio
WANG Wu-Lian. Nanocubos de Fe4[Fe(CN)6]3 de alta calidad: Síntesis y rendimiento electroquímico como material de cátodo para baterías acuosas de iones de sodio. Revista de materiales inorgánicos[J], 2019, 34(12): 1301-1308 doi:10.15541/jim20190076
Prueba de rendimiento electroquímico de nanocubos de Fe4[Fe(CN)6]3 de alta calidad
En primer lugar, se probó el rendimiento electroquímico de HQ-FeHCF y LQ-FeHCF en electrolito Na-H2O-PEG utilizando un sistema de tres electrodos. La Figura 4(a) muestra las curvas de voltamperometría cíclica de HQ-FeHCF y LQ-FeHCF en electrolito Na-H2O-PEG con una velocidad de barrido de 1 mV s-1. Se puede observar claramente en la figura que aparecieron dos pares de picos redox independientes en HQ-FeHCF, lo que indica que ocurrieron dos reacciones redox, correspondientes a la intercalación/desintercalación reversible de dos Na+. El primer par de picos redox apareció a 0,03 y 0,28 V, correspondientes a la reducción y oxidación de iones FeIII/FeII de alto espín unidos a átomos de carbono. El segundo par de picos redox aparece a 1,12 y 1,26 V, correspondiente a la reducción y oxidación de iones FeIII/FeII de bajo espín unidos a átomos de nitrógeno. A la misma velocidad de exploración,
La Figura 4(b) muestra las curvas de carga-descarga de corriente constante de HQ-FeHCF y LQ-FeHCF a una tasa de 1C (1C= 120 mA g-1). Se puede ver claramente en la figura que HQ-FeHCF tiene dos mesetas de voltaje durante el proceso de carga y descarga, lo que indica que la inserción/extracción de Na+ se completa en dos pasos. Esto corresponde a los dos pares de picos redox que aparecen en la Fig. 4(a). LQ-FeHCF muestra curvas de carga y descarga similares a las de HQ-FeHCF, pero su capacidad de descarga es significativamente menor que la de HQ-FeHCF.
La Figura 4(c) muestra el rendimiento de la tasa de HQ-FeHCF y LQ-FeHCF. En la figura se puede ver que las capacidades específicas de HQ-FeHCF a tasas de 1C, 2C, 5C, 10C, 20C, 30C y 40C son 124, 118, 105, 94, 83, 74 y 63 mAh·g-1, respectivamente. Cabe señalar que al regresar nuevamente a 1C, la capacidad se recuperó a 124 mAh·g-1, mostrando un excelente desempeño de tasa. Hay dos razones por las que HQ-FeHCF tiene un rendimiento de tasa tan bueno: en primer lugar, el material HQ-FeHCF sintetizado por el método en este documento tiene alta calidad y pocos defectos de vacantes, lo que garantiza el transporte eficiente de Na+. En segundo lugar, la gran estructura de canales del material acorta la ruta de transporte de Na+. Además, la estructura de HQ-FeHCF sintetizada lentamente mediante la adición de PVP es muy estable, y los ciclos de carga y descarga de alta velocidad no provocarán el colapso estructural de HQ-FeHCF. resultando en la degradación del rendimiento electroquímico. Las capacidades específicas de LQ-FeHCF a tasas de 1C, 2C, 5C, 10C, 20C, 30C y 40C son 112, 104, 81, 59, 35, 18 y 7 mAh·g-1, respectivamente. El rendimiento general de la tasa es peor que el de HQ-FeHCF, especialmente a tasas altas, la brecha es particularmente obvia. Esto se debe a que LQ-FeHCF no tiene una estructura estable, y hay una gran cantidad de defectos vacantes de [Fe(CN)6] y agua cristalina en su cristal, lo que dificulta la desintercalación de Na+, lo que da como resultado una capacidad específica extremadamente baja de LQ -FeHCF a grandes aumentos. especialmente a tasas altas, la brecha es particularmente obvia. Esto se debe a que LQ-FeHCF no tiene una estructura estable, y hay una gran cantidad de defectos vacantes de [Fe(CN)6] y agua cristalina en su cristal, lo que dificulta la desintercalación de Na+, lo que da como resultado una capacidad específica extremadamente baja de LQ -FeHCF a grandes aumentos. especialmente a tasas altas, la brecha es particularmente obvia. Esto se debe a que LQ-FeHCF no tiene una estructura estable, y hay una gran cantidad de defectos vacantes de [Fe(CN)6] y agua cristalina en su cristal, lo que dificulta la desintercalación de Na+, lo que da como resultado una capacidad específica extremadamente baja de LQ -FeHCF a grandes aumentos.
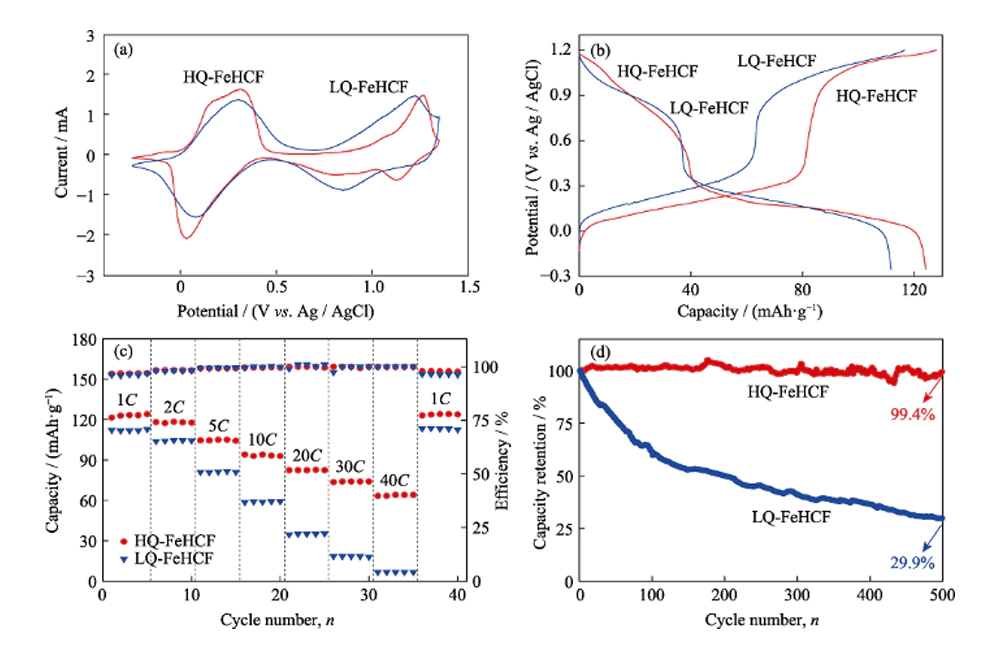
Fig. 4 (a) Curvas de voltamograma cíclico (CV) de HQ-FeHCF y LQ-FeHCF a la velocidad de barrido de 1 mV·s-1 en el electrolito de Na-H2O-PEG; (b) Curvas de carga y descarga de HQ-FeHCF y LQ-FeHCF a 1C; (c) Tasa de rendimiento de HQ-FeHCF y LQ-FeHCF; (d) Rendimiento cíclico de HQ-FeHCF y LQ-FeHCF
La estabilidad del ciclo es un parámetro importante para las baterías acuosas de iones de Na en aplicaciones prácticas. El rendimiento del ciclo de HQ-FeHCF y LQ-FeHCF a una tasa de 5C se muestra en la Fig. 4 (d). La capacidad de descarga de LQ-FeHCF en el primer ciclo es de 87 mAh·g-1, pero su capacidad disminuye rápidamente con el aumento de los tiempos de ciclo. Después de 100 ciclos, la tasa de retención de capacidad fue del 61 % y después de 500 ciclos, la capacidad fue de solo 26 mAh·g-1, lo que corresponde a una tasa de retención de capacidad del 29,9 %. HQ-FeHCF muestra una estabilidad de ciclo extremadamente excelente. Después de 100 ciclos, la capacidad de HQ-FeHCF no disminuyó significativamente, manteniendo una tasa de retención de capacidad del 100 %, y la tasa de retención de capacidad aún era tan alta como 99,4 % hasta el ciclo 500.
Para verificar aún más la estabilidad de HQ-FeHCF en el electrolito Na-H2O-PEG, se observaron los electrodos después de 100 ciclos y 500 ciclos mediante SEM. Como se muestra en la Figura 5, la Figura 5(a~b) es la foto SEM de HQ-FeHCF en electrolito Na-H2O-PEG después de 100 veces de carga y descarga de corriente constante a 5C. Se puede ver claramente en la figura que cada partícula de nanocubo de HQ-FeHCF mantiene un alto grado de integridad, casi sin daño estructural y sin defectos en la superficie de la partícula. La Figura 5(c~d) son fotos SEM de HQ-FeHCF en electrolito Na-H2O-PEG después de 500 cargas y descargas de corriente constante a 5C. Cada partícula de nanocubo de HQ-FeHCF también mantiene un alto grado de integridad sin deformación estructural ni colapso. La pieza polar después de 500 ciclos se sometió a la prueba TG, como se muestra en la Figura 6. El contenido de agua de cristalización de HQ-FeHCF fue del 13 %, sin cambios significativos en comparación con antes del ciclo; el contenido de agua cristalina de LQ-FeHCF fue del 20 %, un aumento del 2 % en comparación con antes del ciclo.

Fig. 5 Imágenes SEM de HQ-FeHCF después de (ab) 100 y (cd) 500 ciclos
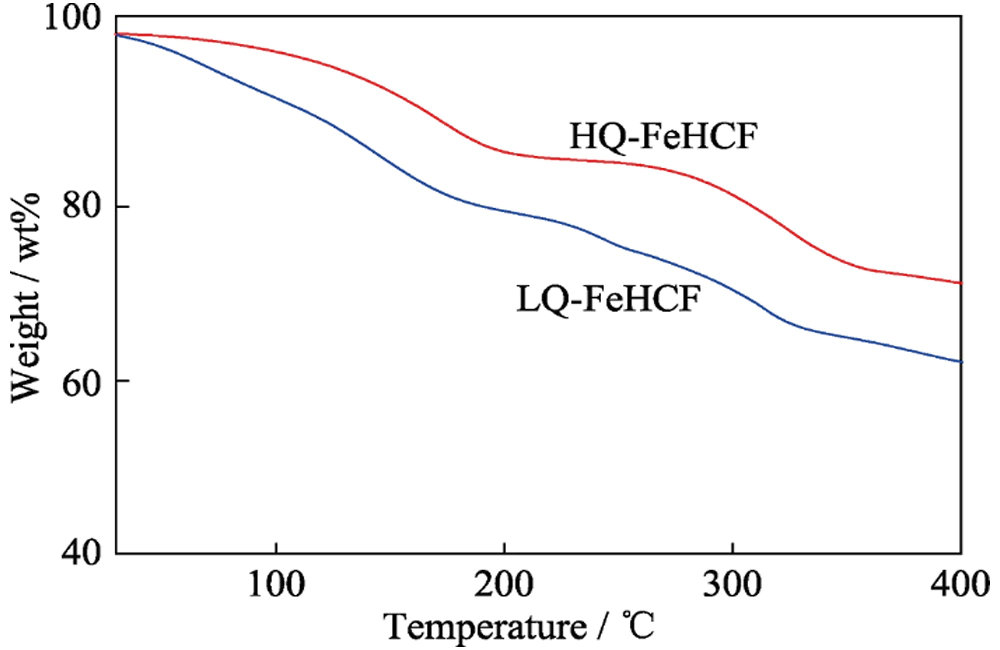
Fig. 6 Curvas TG de HQ-FeHCF y LQ-FeHCF después de 500 ciclos
El mecanismo de transición de fase del material HQ-FeHCF durante la reacción electroquímica se estudió mediante la técnica XRD ex situ. La Figura 7 muestra los patrones XRD del material bajo diferentes estados de carga y descarga, a~e son el proceso de carga, f~i son el proceso de descarga, y los puntos están marcados con picos de difracción de Ti. Tomando como ejemplo el grupo de picos de difracción en el cuadro de la línea de puntos, se puede ver claramente en la figura que los picos de difracción XRD cambian en la dirección de aumentar 2θ durante el proceso de a~, de 24,3° a 24,6°. Esto se debe a la contracción de la red provocada por la extracción de Na+ del HQ-FeHCF durante el proceso de carga. El cambio de volumen de la celda unitaria durante este proceso es de aproximadamente 8,1%. Durante el proceso f~i, el pico de difracción XRD cambia a la dirección de disminución de 2θ y vuelve a 24. 3° otra vez. Esto se debe a que el Na+ se reintercala en HQ-FeHCF durante el proceso de descarga, provocando la expansión de la red. Vale la pena señalar que las posiciones de los picos de difracción a e i son muy coincidentes. Esto indica que la desintercalación de Na+ en el material HQ-FeHCF es altamente reversible, y la desintercalación reversible de Na+ no destruirá la estructura cristalina del material. También muestra que HQ-FeHCF tiene una alta estabilidad en el electrolito Na-H2O-PEG.
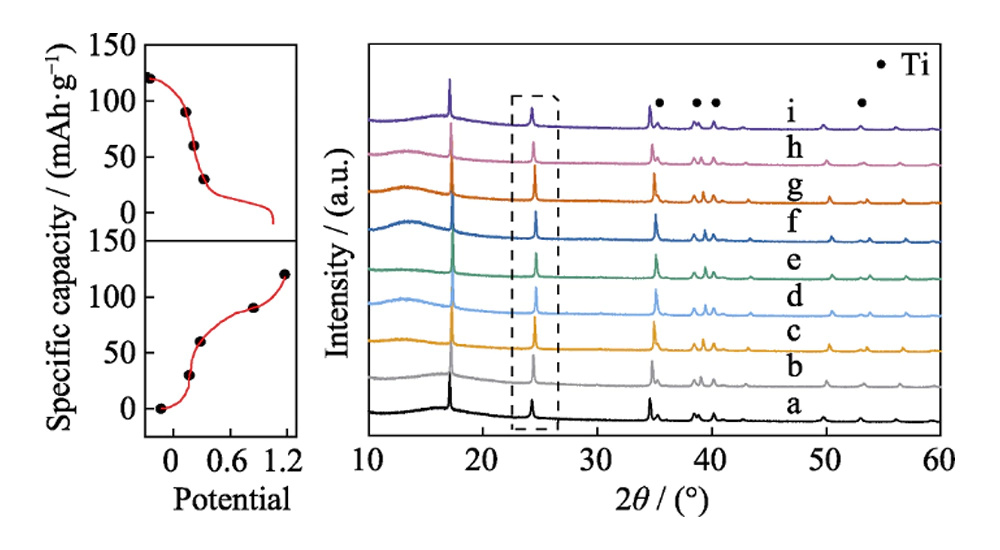
Fig. 7 Patrones XRD ex situ de material HQ-FeHCF en varios estados de carga y descarga
El NaTi2(PO4)3 tipo NASICON tiene una estructura tridimensional abierta adecuada para la difusión de iones de sodio. Por lo tanto, NaTi2(PO4)3 puede usarse no solo como material de electrodo para baterías orgánicas de iones de sodio, sino también como material de electrodo para baterías acuosas de iones de sodio. NaTi2(PO4)3 fue preparado por un método previo, y sus propiedades electroquímicas en electrolito Na-H2O-PEG fueron estudiadas por voltamperometría cíclica (CV) y carga-descarga galvanostática. La figura 8(a) muestra la curva CV de NaTi2(PO4)3 a una velocidad de exploración de 1 mV s-1, con un par de picos redox agudos a -0,64 y -0,79 V (frente a Ag/AgCl). Esto corresponde a la intercalación/extracción de Na+, acompañada de la conversión reversible entre Ti3+ y Ti4+. La distribución de voltaje de NaTi2(PO4)3 se muestra en la Figura 8(b). La plataforma de descarga plana a -0,69 V (vs.
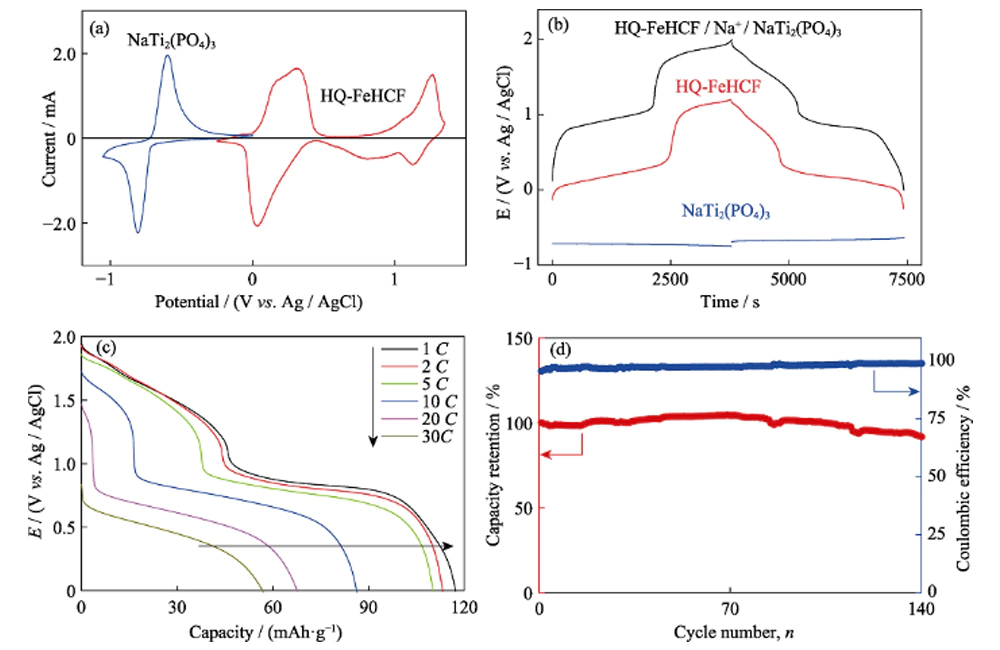
Fig. 8 (a) Curvas de voltamograma cíclico (CV) de HQ-FeHCF y NaTi2(PO4) a la velocidad de barrido de 1 mV·s-1 en el electrolito de Na-H2O-PEG; (b) Perfiles galvanostáticos de carga-descarga a 1C para celda completa, cátodo y ánodo en el electrolito de Na-H2O-PEG; (c) Tasa de rendimiento y (d) rendimiento de ciclismo de celda completa
Buen rendimiento electroquímico basado en HQ-FeHCF y NaTi2(PO4)3. Ensamblamos una batería completa acuosa de iones de sodio con HQ-FeHCF como electrodo positivo, NaTi2 (PO4) 3 como electrodo negativo y NaClO4-H2O-PEG como electrolito. La Figura 8(b) muestra las curvas de voltaje del electrodo positivo, el electrodo negativo y la batería llena a una tasa de 1C. Se puede ver en la figura que el voltaje de trabajo de la batería completa es tan alto como 1.9 V. Un alto voltaje de trabajo conduce a mejorar la densidad de energía de la batería completa, y la densidad de energía de la batería completa calculada en base a la la masa del material activo es tan alta como 126 Wh kg-1. Supera la densidad de energía de la mayoría de las celdas completas acuosas de iones de Na reportadas anteriormente que utilizan óxido de manganeso, fosfato y azul de Prusia como materiales de cátodo. La comparación específica se muestra en la Tabla 3. Como se muestra en la Fig. 8(c), a razón de 1C, 2C, 5C, 10C, 20C y 30C, las capacidades de la batería completa son 117, 113, 110, 86, 68 y 57 mAh·g-1, respectivamente, lo que demuestra ese excelente desempeño de tasa. La Figura 8(d) muestra el rendimiento del ciclo de la batería completa a una tasa de 5C. En los primeros 70 ciclos, la capacidad de la batería completa aumenta ligeramente y la eficiencia de Coulombic aumenta gradualmente desde el 96% en el primer ciclo hasta un nivel cercano al 100%. En los siguientes 70 ciclos, la capacidad comenzó a disminuir lentamente, hasta el ciclo 140, la tasa de retención de capacidad de la batería completa fue del 92 % y la eficiencia de Coulombic se mantuvo cerca del 100 %. Aunque el voltaje de carga de corte de la batería completa es tan alto como 2 V, superando con creces el voltaje de descomposición teórico del agua (1,23 V),
Tabla 3 Densidad de energía de diferentes baterías acuosas de iones de sodio
| Cátodo |
Un movimiento de cabezami |
Densidad de energía / (Wh·kg-1) |
Árbitro. |
| Na0.44MnO2 |
NaTi2(PO4)3 |
33 |
[39] |
| Na2Ni[Fe(CN)6] |
NaTi2(PO4)3 |
43 |
[13] |
| Na2Cu[Fe(CN)6] |
NaTi2(PO4)3 |
48 |
[40] |
| NaMnO2 |
NaTi2(PO4)3 |
30 |
[12] |
| K0.27MnO2 |
NaTi2(PO4)3 |
55 |
[41] |
| NaFePO4 |
NaTi2(PO4)3 |
61 |
[42] |
| Na2VTi(PO4)3 |
NaTi2(PO4)3 |
68 |
[43] |
| Na3MnTi(PO4)3 |
NaTi2(PO4)3 |
82 |
[44] |
| Na0.66Mn0.66Ti0.34O2 |
NaTi2(PO4)3 |
76 |
[45] |
| Na2Ni0.4Co0.6[Fe(CN)6] |
NaTi2(PO4)3 |
121 |
[46] |
| Fe4[Fe(CN)6]3 |
NaTi2(PO4)3 |
126 |
Este trabajo |
Conclusión
En este estudio, se sintetizaron con éxito nanomateriales de Fe4[Fe(CN)6]3 de alta calidad y con pocos defectos mediante un método hidrotermal simple y conveniente. Los resultados de la prueba XRD muestran que el material es una estructura cúbica centrada en las caras (fcc), que pertenece al grupo de puntos espaciales Fm-3m. Los resultados de las pruebas SEM y TEM muestran que el Fe4[Fe(CN)6]3 sintetizado tiene una excelente cristalinidad y el material tiene una estructura cúbica típica con una longitud lateral de aproximadamente 500 nm. La superficie del material es lisa y uniforme sin acumulaciones importantes. Comparado con el Fe4[Fe(CN)6]3 de baja calidad sintetizado por métodos tradicionales. El Fe4[Fe(CN)6]3 sintetizado en este documento puede reducir efectivamente los defectos de vacantes y regular el agua cristalina en el material, de modo que el material tenga un excelente rendimiento electroquímico: La capacidad específica a una tasa de 1C es tan alta como 124 mAh·g-1, y la capacidad específica a una tasa de 2C, 5C, 10C, 20C, 30C y 40C es de 124, 118, 105, 94, 83, 74 y 64 mAh· g-1, respectivamente, mostrando un excelente desempeño de la tasa. Después de 500 ciclos a una velocidad de 5C, la tasa de retención de capacidad es cercana al 100 %, lo que muestra una excelente estabilidad del ciclo. El voltaje de trabajo de la batería completa con Fe4[Fe(CN)6]3 y fosfato de sodio y titanio como electrodos positivo y negativo es de hasta 1,9 V, y la densidad de energía puede alcanzar los 126 Wh kg-1. Después de 140 veces de carga y descarga de corriente constante a una tasa de 5C, la tasa de retención de la capacidad total de la batería es del 92% y la eficiencia de Coulombic está cerca del 100%. Se espera que el Fe4[Fe(CN)6]3 sintetizado por este método conveniente y amigable con el medio ambiente se use como material de cátodo para baterías acuosas de iones de Na.
Obtenga más información sobre los materiales de las baterías de iones de sodio de TOB NEW ENERGY .