Recubrimiento de carbono dopado F Ánodo Nano-Si de Alta Capacidad: Preparación mediante Fluoración Gaseosa y Rendimiento para almacenamiento de litio
Autor: SU Nan, QIU Jieshan, WANG Zhiyu. dopado con F Ánodo de Nano-Si recubierto de carbono de alta capacidad: preparación mediante fluoración gaseosa y Rendimiento para el Almacenamiento de Litio. Revista de materiales inorgánicos, 2023, 38 (8): 947-953 DOI:10.15541/jim20230009
Resumen
Los ánodos de Si tienen un inmenso potencial en el desarrollo de iones de litio de alta energía baterías. Pero el fallo rápido debido al enorme cambio de volumen tras la absorción de Li impide su aplicación. Este trabajo informa sobre una fluoración de gas fácil pero poco tóxica. forma de producir materiales de ánodos de nano-Si recubiertos de carbono dopados con F. Recubrimiento de El nano-Si con carbono dopado con F que contiene altos defectos puede proteger eficazmente el Si desde un gran cambio de volumen en el almacenamiento de Li al tiempo que se facilita el transporte y formación de interfase de electrolito sólido (SEI) estable rica en LiF. Este ánodo exhibe altas capacidades de 1540-580 mAh·g-1 en varios tasas actuales de 0,2-5,0 A·g-1, manteniendo al mismo tiempo 75% de capacidad después de 200 ciclos. Este método también aborda las cuestiones de Alto costo y toxicidad de las técnicas tradicionales de fluoración que utilizan flúor. fuentes como XeF2 y F2.
Palabras claveï¼ Batería de iones de litio; Ánodo de Si; carbono dopado con F; fluoración gaseosa método
Desarrollar un almacenamiento de energía eficiente y las tecnologías de conversión ayudarán a lograr el objetivo de alcanzar el pico de carbono y neutralidad de carbono”. Las baterías de iones de litio son actualmente una de las más utilizadas utilizó tecnologías de almacenamiento de energía de alta eficiencia [1]. Sin embargo, comercial Los ánodos de grafito tienen una baja capacidad de almacenamiento de litio, lo que limita en gran medida la Densidad de energía de las baterías de iones de litio [2]. El silicio tiene las ventajas de un bajo reservas potenciales y abundantes, y su capacidad teórica específica (4200 mAh·g-1) es mucho mayor que el del ánodo de grafito, por lo que se considera como un material de ánodo candidato para reemplazar el grafito [3]. Los materiales de silicio logran almacenamiento de litio basado en la reacción de aleación reversible con iones de litio, pero este proceso va acompañado de enormes cambios de volumen (~400%), lo que conduce a Pulverización rápida y fallo del electrodo, convirtiéndose en un cuello de botella clave. restringiendo la aplicación práctica de los ánodos de silicio [3-4].
En los últimos años, los investigadores han desarrolló una variedad de estrategias para mejorar la estabilidad y la electroquímica. Rendimiento de los ánodos de silicio. Tales como: nanometerización [5], estructural compuesto con carbono conductor y otros materiales [6-7], etc. Mejorar la Estabilidad estructural del ánodo de silicio al aliviar la tensión mecánica. asociado con la expansión del volumen de almacenamiento de litio en el nivel microscópico escala. Desarrollar nuevos electrolitos o aditivos de electrolitos para mejorar la Estabilidad y eficiencia coulómbica de la fase de interfaz del electrolito sólido. (SEI) en la superficie del ánodo de silicio [8]. Desarrollar polímero eficiente aglutinantes (como carboximetilcelulosa de sodio, alginato de sodio, poliacrílico polirotaxano de base ácida [9], etc.). Fortalecer la fuerza de unión entre activos materiales, entre materiales activos y red conductora, y entre película de electrodo y colector de corriente [9-10]. Entre ellos, el recubrimiento de carbono es uno de los medios más eficaces para mejorar la estabilidad estructural de los ánodos de silicio y modular las propiedades de superficie y de interfaz [3-4,11]. Sin embargo, la estrecha La capa de carbono recubierta altamente estable también dificulta el transporte de iones de litio y limita el rendimiento completo del ánodo de silicio.
Además, el volumen repetido Cambios del ánodo de silicio durante el proceso de carga y descarga continua. También causa que la película SEI se rompa continuamente y crezca repetidamente, lo que resulta en la pérdida continua de litio activo y electrolito en la superficie del electrodo [12]. En respuesta a los problemas anteriores, este estudio propone una solución eficiente Método de fluoración en fase gaseosa para recubrir la superficie del material del ánodo de silicio. con una capa de carbono amorfo altamente defectuosa rica en elementos flúor para mejorar su estructura y estabilidad de la interfaz. Comparado con el tradicional Tecnología de fluoración que utiliza fuentes de flúor costosas y altamente tóxicas. como XeF2 o F2 [13], esta estrategia es más simple y menos tóxica. El Una capa de carbono dopada con flúor que recubre la superficie de materiales de nanosilicio puede Amortigua eficazmente la expansión del volumen de los ánodos de silicio con litio incorporado. al tiempo que mejora las capacidades de transporte de iones de litio. Y un SEI altamente estable Una película rica en fluoruro inorgánico se construye in situ para lograr el objetivo de mejorando la estabilidad del ciclo del ánodo de silicio.
1 Método experimental
1.1 Preparación del material
Preparación de revestimiento de carbono nanosilicio (Si@C): 0,3 g de nanosílice comercial El polvo (tamaño de partícula 20~100 nm, reactivo de Aladdin) se sometió a ultrasonidos. dispersado en 28 ml de un disolvente mixto de agua desionizada y etanol (volumen relación 5:2). Después de añadir 0,4 ml de 3-aminopropiltrietoxisilano, agitar durante 2 h. para formar una dispersión uniforme A. Disolver 0,115 g de 4,4-dihidroxidifenilo sulfuro y 0,1 g de 3-aminofenol en 28 ml de un disolvente mixto de desionizado agua y etanol (proporción de volumen 5:2) para formar una solución homogénea B. Mezclar dispersión A y solución B uniformemente, agregar 0,1 ml de agua con amoníaco, agitar durante 30 min, luego agregue 0,14 ml de solución de formaldehído (37% ~ 40%) y reaccione con constante agitando a 30°C durante 12 h. Después de la reacción, el revestimiento de resina fenólica La nanosílice (Si@AF) se obtuvo centrifugando y lavando con etanol y agua desionizada alternativamente tres veces. Fue calcinado en gas argón a 800°C. durante 3 h para obtener nanosilicio recubierto de carbono (Si@C).
Preparación de flúor dopado. Nanosilicio recubierto de carbono (Si@C-F): 100 mg Si@C y 200 mg Se colocaron fluoruro de polivinilideno (PVDF) en un horno tubular protegido con argón. El recipiente de cuarzo que contiene PVDF se encuentra aguas arriba del flujo de aire, y el Un recipiente de cuarzo que contiene Si@C se encuentra aguas abajo del flujo de aire. esta asado a 600 °C durante 3 h para obtener nanosilicio recubierto de carbono dopado con flúor (Si@C-F).
1.2 Montaje de la batería y pruebas de rendimiento electroquímico
1.2.1 Conjunto de batería
Ensamble la batería del botón CR2016 para pruebas. Mezcle el material activo, el negro de carbón conductor y aglutinante de carboximetilcelulosa sódica uniformemente en una proporción de masa de 7:2:1. Desionizado Se añadió agua como disolvente y dispersante y la suspensión obtenida se recubierto uniformemente sobre la lámina de cobre como electrodo de trabajo. el material activo la carga fue de 0,8~1,0 mg·cm-2. Se utilizaron láminas metálicas de litio como contador. electrodos y electrodos de referencia. El electrolito es una solución DOL/DME. disuelto en 1,0 mol/L de LiTFSI (bistrifluorometanosulfonato imida de litio) y 2,0 % LiNO3 (DOL es 1, 3-dioxolano, DME es etilenglicol dimetil éter, volumen relación 1:1). Monte la celda en una caja de guantes llena de argón (contenido de agua < 0,1 μL/L, contenido de oxígeno < 0,1 μL/L).
1.2.2 Prueba de rendimiento de la batería
Utilice el electroquímico IVIUM Vertex.C.EIS estación de trabajo para analizar el mecanismo de reacción y la cinética de reacción del batería utilizando el método de voltamperometría cíclica (CV). El rango de voltaje es 0,01 ~ 1,5 V, y la velocidad de barrido es 0,05~0,5 mV·s- 1. Impedancia electroquímica Se utilizó espectroscopía (EIS) para analizar la dinámica de los electrodos. La frecuencia de la prueba el rango fue de 100 kHz ~ 10 mHz y la amplitud del voltaje de perturbación fue de 5,0 mV. Se utilizó el probador de baterías Land CT2001A para estudiar el rendimiento del almacenamiento de litio. utilizando el método de carga y descarga de corriente constante. La ventana de voltaje fue 0,01~1,5 V (frente a Li/Li+) y la densidad de corriente fue de 0,2~5,0 A·g-1.
2 Resultados y discusión
2.1 Análisis de apariencia, estructura y composición de materiales
El proceso de preparación de Los materiales de nanosilicio recubiertos de carbono dopados con flúor se muestran en la Figura 1. En primer lugar, se preparan nanopartículas de silicio recubiertas de polímero (Si@AF) basándose en Reacción de polimerización por condensación de fenol-aldehído y se convierte en Nanopartículas de nanosilicio (Si@C) recubiertas de carbono amorfo a alta temperatura. Entonces Se utiliza fluoruro de polivinilideno como fuente de flúor y el flúor está dopado. en la capa de carbono fuera de las nanopartículas de silicio a través de la fase gaseosa Método de fluoración a alta temperatura. La Figura 2 (a) muestra los patrones XRD de Materiales Si@C y Si@C-F. Picos de difracción ubicados en 2θ=28°, 47°, 56°, 69° y 76°. Corresponden al cristal (111), (220), (311), (400) y (331). planos de silicio monocristalino (JCPDS 77-2108) respectivamente. El amplio pico ubicado a 2θ=25°~26° se atribuye a la estructura de carbono ordenada de corto alcance formada por la carbonización del producto de polimerización por condensación fenólica. El capa de recubrimiento de carbono con alta conductividad y excelente flexibilidad estructural Puede aliviar eficazmente el fallo de pulverización de materiales de silicio durante el proceso de carga y descarga y mejora la conductividad del electrodo. La Figura 2(b) es el espectro Raman de materiales Si@C y Si@C-F, con obvias picos de absorción que aparecen a 515, 947, 1350 y 1594 cm-1. Entre ellos, el Los picos de absorción a 515 y 947 cm-1 son los picos característicos de silicio cristalino, que se derivan del fotófono de primer orden dispersión y dispersión de fotofonones transversales de segundo orden de silicio respectivamente [14]. Los picos de absorción a 1350 y 1594 cm-1 corresponden a la configuración del carbono aromático que estira la vibración (modo G) y el desordenado estructura de carbono defectuosa (modo D), respectivamente. En términos generales, el La relación de intensidad del modo D y el modo G (ID/IG) se puede utilizar para medir el grado. de defectos y desorden de materiales de carbono [15]. Comparado con el material Si@C (ID/IG=0,99), el ID/IG del material Si@C-F aumenta a 1,08. Muestra que el El proceso de fluoración puede aumentar los defectos de la capa de recubrimiento de carbono. lo cual es beneficioso para recubrir herméticamente el nanosilicio y al mismo tiempo mejorar la calidad de los iones de litio. capacidades de transporte.
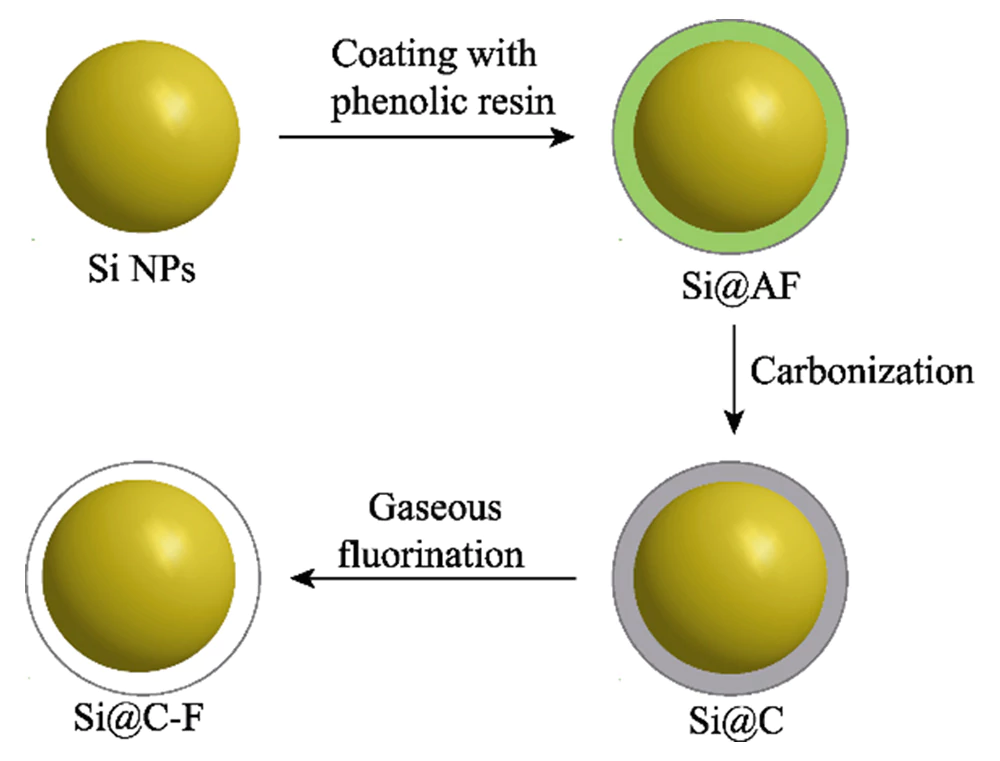
Fig. 1 Ilustración esquemática de la producción de Si@C-F
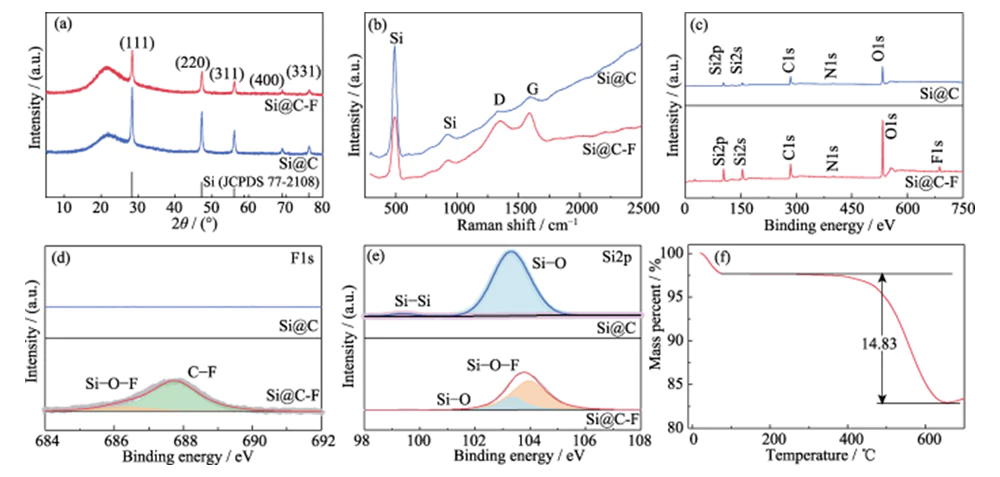
Fig. 2 (a) patrones XRD, (b) espectros Raman, (c) XPS escaneo de encuesta, (d) F1 de alta resolución y (e) espectros Si2p XPS de Si@C y Si@C-F, (f) Curva TGA de Si@C-F
El espectro completo XPS muestra que el El material Si@C contiene elementos O, N, C y Si (Figura 2(c)). el atómico fracción de elemento F en el material Si@C-F obtenido después de la fluoración el tratamiento es aproximadamente del 1,8%. En el espectro XPS del F1 de alta resolución (Figura 2 (d)), los dos picos característicos en la energía de enlace de 686,3 y 687,8 eV corresponden a C-F y Si-O-F respectivamente, y C-F es el dominante uno. Demuestra que el tratamiento de fluoración introdujo con éxito el flúor. elemento en la capa de carbono amorfo recubierta sobre la superficie del nanosilicio. El Los espectros Si2p de alta resolución (Figura 2 (e)) y F1s XPS demuestran que los átomos de Si interactúa químicamente con el elemento F en la capa de carbono formando Si-O-F enlaces, lo que es beneficioso para el revestimiento apretado de la capa de carbono en el superficie de silicio. El análisis termogravimétrico (TGA) muestra que la fracción de masa de Si en el material Si@C-F es aproximadamente 85,17% (Figura 2(f)).
El análisis SEM muestra que el Si@C-F El material está compuesto de nanopartículas con un tamaño de <100 nm (Figura 3 (a ~ c)). Después del tratamiento de carbonización a alta temperatura y fluoración en fase gaseosa, el material de carbono todavía está recubierto uniformemente sobre la superficie de las nanopartículas de silicio.
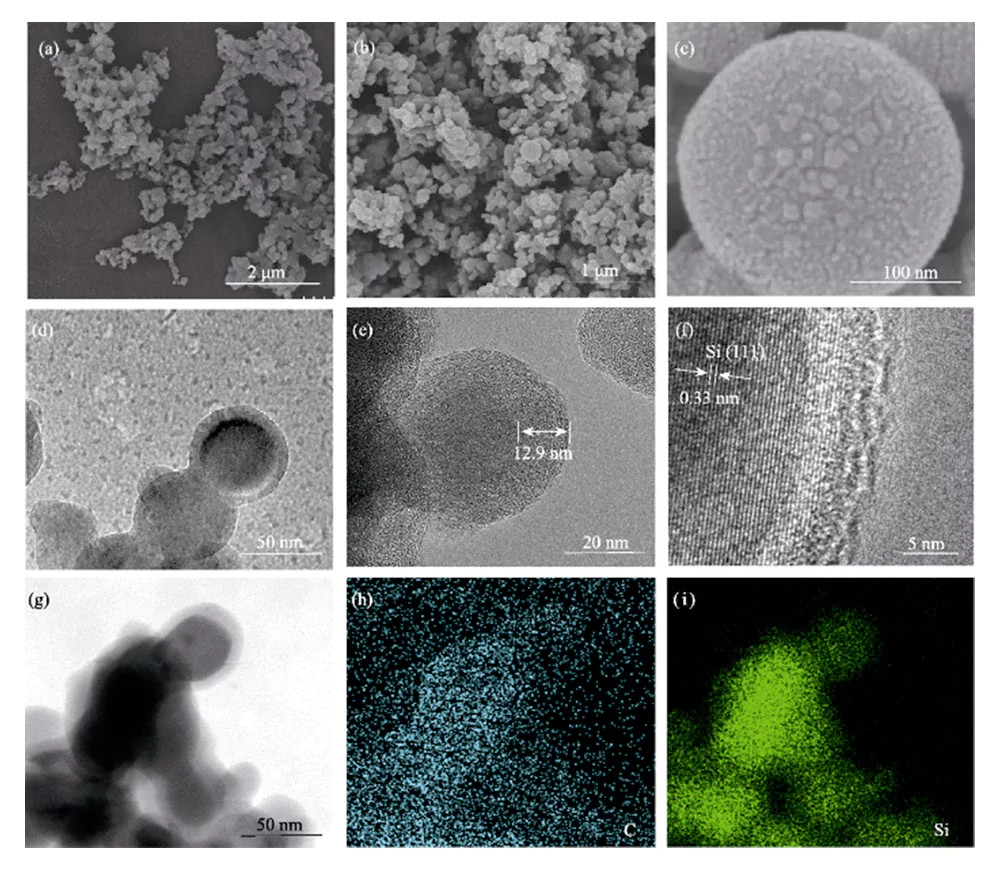
Fig. 3 (a-c) imágenes SEM, (d-f) imágenes TEM y (g-i) mapeo elemental de Si@C-F
El análisis TEM muestra que el silicio Las nanopartículas están recubiertas completa y uniformemente por una capa de carbono con una espesor de unos diez nanómetros, formando una estructura núcleo-capa (Figura 3(d~e)). Las nanopartículas de silicio tienen una estructura monocristalina, en la que el espaciado de la red de 0,328 nm corresponde al plano cristalino (111) de Si, y la capa de carbono dopada con flúor que la cubre tiene una estructura amorfa (Figura 3(f)). El espectro de distribución de elementos demuestra que los elementos C y Si son distribuido uniformemente en Si@C-F (Figura 3(g~i)).
2.2 Propiedades electroquímicas de materiales
La Figura 4 (a, b) es la curva CV de los materiales de ánodo Si@C y Si@C-F. La velocidad de barrido es 0,1 mV·s-1 y el rango de voltaje es 0,01~1,5 V. En el primero ciclo, el pico amplio débil en el rango de 0,1 ~ 0,4 V corresponde al proceso irreversible de descomposición de electrolitos para formar una película SEI; el El pico de reducción a 0,01 V corresponde al proceso del silicio cristalino. Formación de una aleación de silicio-litio (LixSi) mediante una reacción de aleación. Durante el posterior proceso de carga, los dos picos de oxidación a 0,32 y 0,49 V corresponden a la proceso de desaleación de LixSi para formar silicio amorfo [16]. fluoración El tratamiento puede lograr efectos de dopaje estructural y grabado. Un gran número de Los defectos estructurales se introducen en la capa de carbono amorfo recubierta sobre el superficie del material de Si para formar un transporte tridimensional de iones de litio canal, acelerar el transporte de iones de litio y mejorar la electroquímica reactividad del material de Si. Por lo tanto, Si@C-F exhibe una mayor pico de oxidación por delitiación a 0,49 V que el ánodo Si@C sin flúor dopaje. Durante el proceso de descarga posterior, la nueva reducción alcanzó un máximo de 0,19 V corresponde al proceso de inserción de litio del silicio amorfo formado durante el primer proceso de carga [16-17]. A medida que aumenta el número de ciclos, las posiciones del pico de oxidación y el pico de reducción en la curva CV no cambio más largo, lo que indica que los materiales de ánodo Si@C y Si@C-F siguen un patrón similar Mecanismo de almacenamiento de litio de aleación después de la primera carga y descarga. Durante En este proceso, el pico de oxidación y el pico de reducción aumentaron gradualmente, reflejando un proceso típico de activación de electrodos.
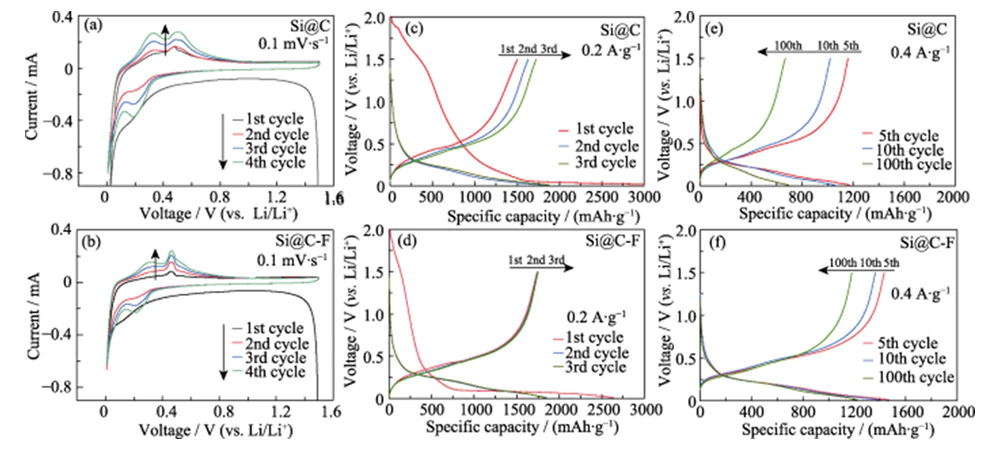
Fig. 4 (a, b) curvas CV a una velocidad de escaneo de 0,1 mV·s-1 y curvas de voltaje de carga-descarga en (c, d) 0,2 y (e, f) 0,4 A·g-1 para (a, c, e) Ánodos Si@C y (b, d, f) Si@C-F
En la carga actual constante y prueba de descarga, el material del ánodo de Si fue ciclado y activado 4 veces a una menor densidad de corriente (0,2 A·g-1), y luego se probó su estabilidad del ciclo a una densidad de corriente de 0,4 A·g-1. La figura 4 (c, d) muestra la carga galvanostática. y curvas de descarga de los ánodos Si@C y Si@C-F a 0,2 A·g-1, y la tensión La ventana es de 0,01 ~ 1,5 V. Durante el primer proceso de descarga, ambos formaron una larga plataforma en el rango de voltaje <0,1 V, correspondiente al proceso de inserción de litio de aleación de silicio cristalino. Este proceso suele ir acompañado de una baja primera eficiencia coulómbica. Durante el primer proceso de carga, la aleación de silicio-litio se delitia y se transforma en silicio amorfo con una energía de activación más baja para la inserción de litio [18], lo que hace que el potencial de inserción del litio aumente a 0,1 ~ 0,3 V después de la primera carga y descarga. En comparación con el Si@C, la capacidad específica de la primera descarga (2640 mAh·g-1) del ánodo Si@C-F es ligeramente menor. Sin embargo, la capacidad específica de la primera carga (1739,6 mAh·g-1) es mayor, y la primera eficiencia Coulombic (65,9%) es aproximadamente un 45,8% mayor que la del ánodo Si@C. La curva de carga-descarga de la región SEI del electrodo negativo Si@C-F es más corta que la de Si@C, lo que indica que se forma una película SEI más estable en la superficie. Esto se debe a que la capa de carbono dopada con flúor favorece la inducción de la formación de una película SEI que contiene componentes inorgánicos (como LiF) y una mayor estabilidad en la superficie del ánodo de silicio, reduciendo así la pérdida irreversible de litio y el consumo de electrolitos [19].
La Figura 4 (e ~ f) muestra las curvas de carga y descarga de Si@C y Electrodos negativos Si@C-F a una densidad de corriente de 0,4 A·g-1 después de la activación. Después de 100 ciclos, el ánodo Si@C-F aún puede mantener una capacidad específica alta de 1223 mAh·g-1, con una tasa de retención de capacidad de 85% (Figura 5(a)). Bajo mismas condiciones, la capacidad del electrodo negativo Si@C sin el tratamiento de fluoración se descompuso rápidamente durante el proceso de carga y descarga, y la tasa de retención de capacidad después de 100 ciclos fue solo del 62%. muestra que La capa de recubrimiento de carbono dopada con flúor tiene un efecto significativo en la mejora. la estabilidad del ciclo del ánodo de silicio. Comercial Los ánodos de nanosilicio sin recubrimiento de carbono fallarán después de más de 10 ciclos. debido a la enorme expansión del volumen y la pulverización estructural durante el desintercalación del litio. Durante este proceso, la capacidad específica de Los electrodos negativos Si@C-F y Si@C aumentan gradualmente en los primeros 10 a 20 ciclos debido al efecto de activación. Con una gran densidad de corriente de 0,2 ~ 5,0 A·g-1, el ánodo Si@C-F puede mantener una alta capacidad específica de 1540~580 mAh·g-1, que muestra una excelente retención de capacidad (Figura 5(b)). En una corriente alta densidad de 5,0 A·g-1, su tasa de retención de capacidad es aproximadamente un 78% mayor que el de Si@C. Cuando la densidad de corriente se reduce aún más a 0,2 A·g-1, la capacidad específica se puede restaurar a 1450 mAh·g-1, lo que indica que su La estructura es muy estable durante el almacenamiento de litio a alta velocidad. Después de 200 ciclos de carga-descarga a una densidad de corriente de 0,2 A·g-1, el ánodo Si@C-F puede mantener una capacidad específica de 75%. La tasa de retención de capacidad del El ánodo de Si@C sin tratamiento de fluoración es solo del 40% (Figura 5(c)). Este ánodo también muestra un mejor rendimiento de almacenamiento de litio que el material del ánodo de silicio informado en la literatura (Tabla 1).
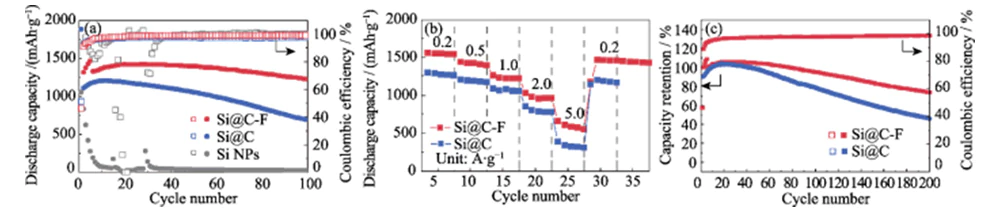
Fig. 5 (a) Estabilidad cíclica a una densidad de corriente de 0,4 A·g-1 con ánodos activados por 4 ciclos a 0,2 A·g-1 antes del ciclo, y (b) capacidad de velocidad en varias densidades de corriente que van desde 0,2 a 5,0 A·gâ1 y (c) retención de capacidad a una densidad de corriente de 0,2 A·g-1 para almacenamiento de litio en ánodos Si@C y Si@C-F
Tabla 1 Comparación del ánodo Si@C-F con informó ánodo a base de Si en rendimiento electroquímico
|
Materiales |
CE inicial |
Capacidad inicial/(mAh·g-1) |
Retención de capacidadretención |
Ref. |
|
Si@C-F |
65,9% |
2640 |
85% (100 ciclos) |
Este trabajo |
|
nano-Si/TiN@ |
71% |
2716 |
59,4% (110 ciclos) |
[20] |
|
Si@C@RGO |
74,5% |
1474 |
48,9% (40 ciclos) |
[21] |
|
Si@FA |
65% |
1334 |
68,7% (100 ciclos) |
[22] |
|
p-Si@C |
58% |
3460 |
57,5% (100 ciclos) |
[23] |
|
Si@vacío@C |
- |
900 |
70% (100 ciclos) |
[24] |
|
Si/C@C |
- |
1120 |
80% (100 ciclos) |
[25] |
En una corriente alta densidad de 5,0 A·g-1, su tasa de retención de capacidad es aproximadamente un 78% mayor que el de Si@C. Cuando la densidad de corriente se reduce aún más a 0,2 A·g-1, la capacidad específica se puede restaurar a 1450 mAh·g-1, lo que indica que su La estructura es muy estable durante el almacenamiento de litio a alta velocidad. Después de 200 ciclos de carga-descarga a una densidad de corriente de 0,2 A·g-1, el ánodo Si@C-F puede mantener una capacidad específica de 75%. La tasa de retención de capacidad del El ánodo de Si@C sin tratamiento de fluoración es solo del 40% (Figura 5(c)). Este ánodo también muestra un mejor rendimiento de almacenamiento de litio que el material del ánodo de silicio reportado en la literatura (Tabla 1). La cantidad de dopaje con flúor en el recubrimiento. La capa de carbono tiene un impacto significativo en el rendimiento del almacenamiento de litio del Ánodo Si@C-F. Cuando la cantidad de dopaje con flúor es inferior al 1,8% de fracción atómica, La estabilidad cíclica del ánodo Si@C-F mejora significativamente a medida que la cantidad de dopaje con flúor aumenta (Figura 6). Esto se debe al efecto potenciado del dopaje con flúor sobre las propiedades de transporte de iones de litio del carbono capa de recubrimiento y la estabilidad de la película SEI en la superficie del silicio material. Cuando la proporción de dopaje con flúor es demasiado alta (2,7%), el recubierto de carbono El material del ánodo de Si todavía mantiene una buena estabilidad del ciclo, pero el la capacidad específica cae significativamente. Esto se debe a la pérdida de Si activo. causado por el grabado de especies de flúor en fase gaseosa durante altas temperaturas. fluoración. Cuando la cantidad de dopaje con flúor es del 1,8 por ciento atómico, el Si@C-F El ánodo exhibe una estabilidad de ciclo óptima y una alta capacidad específica.
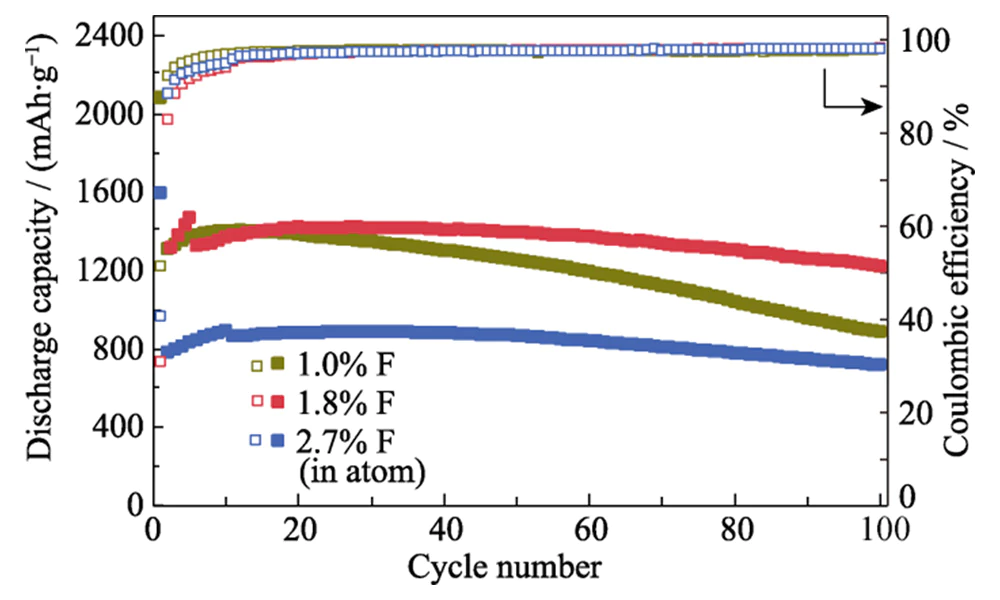
Fig. 6 Estabilidad cíclica de ánodos Si@C-F con diferentes Relaciones F a una densidad de corriente de 0,4 A·g-1 con ánodos activados por 4-10 ciclos a 0,2 A·g-1 antes del ciclo
Los espectros EIS de Si@C y Si@C-F Los ánodos consisten en curvas de semiarco en la región de frecuencia media a alta y líneas rectas inclinadas en la región de baja frecuencia (Figura 7 (a)). el semiarco La curva en el rango de frecuencia media a alta está relacionada con la transferencia de carga. resistencia (Rct) y la línea recta inclinada en el rango de baja frecuencia refleja principalmente la impedancia de Warburg (ZW) de la difusión de iones de litio [26]. Antes de cargar y descargar, el Rct de los electrodos negativos Si@C-F y Si@C son similares, pero el primero tiene un ZW más bajo debido al alto defecto capa de carbono dopada con flúor que cubre la superficie. Después de la carga y descarga ciclos, el Rct (5,51 Ω) del ánodo Si@C-F es significativamente menor que el del ánodo Si @ C (21,97 Î ©) (Figura 7 (b)), y el ZW es mucho más bajo que el último. Esto muestra que la película de interfaz SEI rica en flúor inducida por el La capa de carbono dopada con flúor puede mejorar eficazmente la carga de la interfaz y Capacidades de transporte de iones de litio.
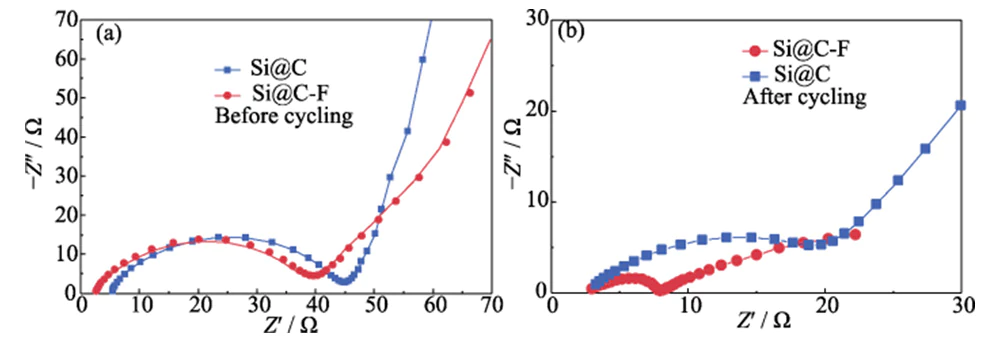
Fig. 7 Gráficos de Nyquist de los ánodos Si@C y Si@C-F (a) antes y (b) después de realizar el ciclo con una densidad de corriente de 0,4 A·g-1
2.3 Caracterización de la estructura del electrodo después de carga y descarga
Caracterización SEM después de carga y descarga. ciclos (Figura 8 (a ~ c)) muestra que debido a la importante expansión del volumen efecto del silicio durante el proceso de inserción del litio, el espesor del El electrodo Si@C aumentó un 132,3%. Esto no sólo dificulta la transmisión de iones y electrones, aumenta la resistencia interna y la polarización del electrodo, pero también causa una enorme tensión mecánica, haciendo que el electrodo se romperse y separarse del colector de corriente, provocando el funcionamiento del El ánodo de Si @ C se descompondrá rápidamente (Figura 5 (c)). En comparación, el electrodo El espesor del ánodo Si@C-F aumentó sólo un 26,6% después de la carga y ciclos de descarga y mantuvo una buena estabilidad estructural del electrodo (Figura 8(d~f)). Esto muestra que la capa de carbono dopada con flúor introducida puede Amortigua eficazmente el efecto de expansión de volumen de la inserción de litio en silicio. materiales a microescala, mejorando así la estabilidad estructural del electrodo en la escala macro de abajo hacia arriba.
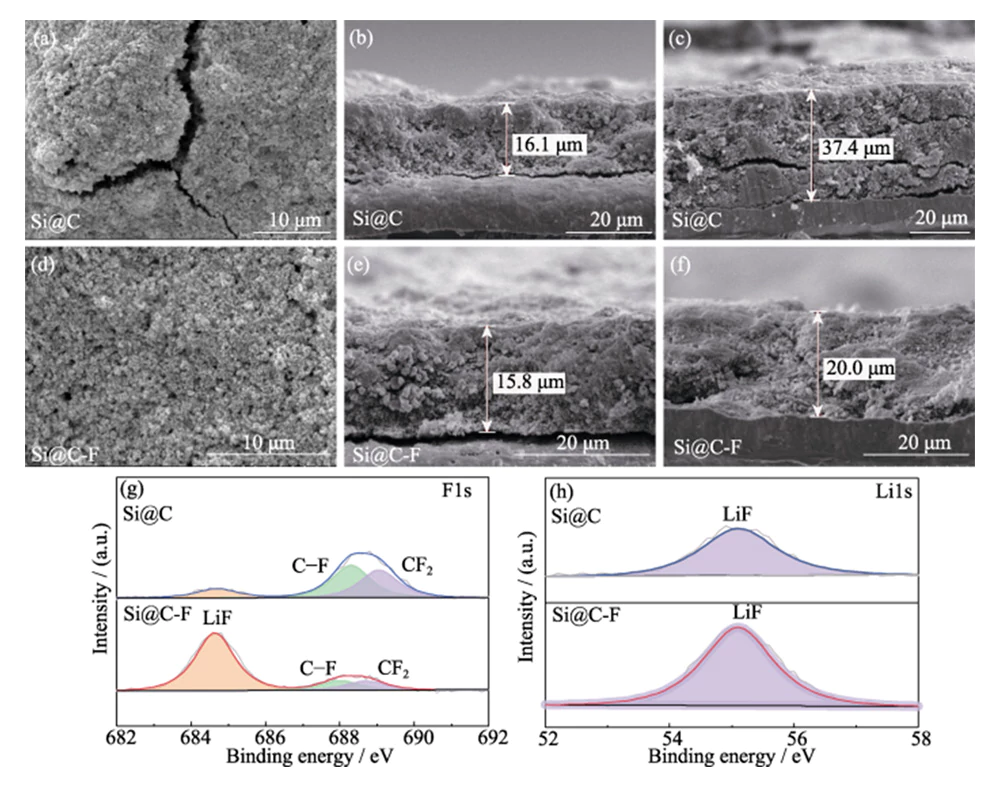
Fig. 8 Imágenes SEM superiores de (a) ánodos Si@C y (d) Si@C-F después de andar en bicicleta; Imágenes SEM de sección transversal de ánodos (b, c) Si@C y (e, f) Si@C-F (b, e) antes y (c, f) después del ciclismo; Alta resolución (g) F1s y (h) Li1s Espectros XPS de SEI en ánodos Si@C y Si@C-F después del ciclo
La composición de la película SEI sobre la superficie de Si@C. y electrodos negativos Si @ C-F después de los ciclos de carga y descarga. por XPS (Figura 8(g~h)). En el espectro XPS F1s de alta resolución, la unión Los picos de energía en las energías de enlace de 684,8, 688,3 y 689,1 eV corresponden a LiF, bonos C-F y CF2, respectivamente. En consecuencia, también existen picos característicos correspondientes a especies de LiF en los Li1s de alta resolución Espectro XPS, que indica que se forma una película SEI que contiene especies LiF en la superficie del ánodo de silicio. En comparación con el ánodo Si@C, el contenido de LiF en la superficie del ánodo Si@C-F es mayor, lo que indica que el LiF en el La película SEI proviene no sólo de la descomposición de sales de litio en el electrolito, sino también del F en la capa de carbono dopada con flúor. El La formación de LiF de alto módulo puede aumentar efectivamente la resistencia estructural. de la película SEI e inhibe el cambio de volumen de la inserción de litio en silicio materiales. Al mismo tiempo, la amplia banda prohibida y las propiedades aislantes del LiF puede reducir el espesor del SEI y reducir la pérdida irreversible inicial de litio. La aleación LixSi, el producto de litiación de LiF y Si, tiene una alta interfacial. energía y puede adaptarse mejor a la deformación plástica del silicio litiado. ánodo durante el ciclo, mejorando así aún más la estabilidad del ciclo del electrodo [19].
3 Conclusión
En este estudio, dopados con flúor Los materiales de nanosilicio recubiertos de carbono se prepararon mediante un método simple y Método de fluoración en fase gaseosa poco tóxico. Las investigaciones muestran que el dopaje con flúor (1,8% F), por un lado, aumenta los defectos de la capa de recubrimiento de carbono en la superficie del silicio y proporciona abundantes canales de transporte de iones de litio mientras Recubrimiento hermético de nanosilicio para suprimir su expansión de volumen. por el otro Por otro lado, se induce una película SEI altamente estable rica en LiF en la superficie del Material de nanosilicio, que mejora aún más la estabilidad y la eficiencia Coulombic. del ánodo de silicio. Gracias a esto, se obtuvo la primera eficiencia coulombiana del El ánodo de nanosilicio recubierto de carbono dopado con flúor mejoró al 65,9%. en una corriente densidad de 0,2~5,0 A·g-1, exhibe una alta capacidad específica de 1540~580 mAh·g-1, y puede mantener 75% de la capacidad inicial después de 200 ciclos. Este trabajo aporta nuevas ideas para el diseño y construcción de ánodos de silicio. Materiales con alta capacidad y alta estabilidad.
Referencia
[1] NIU S S, WANG Z Y, YU M L, et al. Basado en MXene Electrodo con pseudocapacitancia mejorada y capacidad volumétrica para potencia. tipo y almacenamiento de litio de vida ultralarga.ACS Nano, 2018, 12(4): 3928.
[2] SU X, WU Q L, LI J C, et al. Nanomateriales a base de silicio para Baterías de iones de litio: una revisión. Advanced Energy Materials, 2014, 4(1): 1300882.
[3] GE M Z, CAO C Y, GILL M B, et al. Avances recientes en electrodos a base de silicio: de la investigación fundamental a la práctica Aplicaciones. Materiales avanzados, 2021, 33(16): 2004577.
[4] LI P, ZHAO G Q, ZHENG X B, et al. Progreso reciente en tecnología basada en silicio Materiales anódicos para aplicaciones prácticas de baterías de iones de litio.Energía Materiales de almacenamiento, 2018, 15: 422.
[5] LIU X H, ZHONG L, HUANG S, et al. Depende del tamaño fractura de nanopartículas de silicio durante la litiación.ACS Nano, 2012, 6(2): 1522.
[6] LUO W, WANG Y X, CHOU S L, et al. Espesor crítico de fenólico Capa interfacial de carbono a base de resina para mejorar la estabilidad de ciclos largos de Ánodos de nanopartículas de silicio.Nano Energy, 2016, 27: 255.
[7] DOU F, SHI L Y, CHEN G R, Materiales de ánodo compuesto de silicio/carbono para baterías de iones de litio. Reseñas de energía electroquímica, 2019, 2(1): 149.
[8] JIA H P, ZOU L F, GAO P Y, et al. Alto rendimiento ánodos de silicio habilitados por alta concentración localizada no inflamable electrolitos.Advanced Energy Materials, 2019, 9(31): 1900784.
[9] CHOIS H, KWON T W, COSKUN A, et al. Altamente elástico Aglutinantes que integran polirotaxanos para ánodos de micropartículas de silicio en litio. Baterías de iones. Science, 2017, 357: 279.
[10] LI Z H, ZHANG Y P, LIU T F, et al. Ánodo de silicio con alta eficiencia Coulombic inicial mediante aglutinante trifuncional modulado para Baterías de iones de litio de alta capacidad. Energía avanzada Materiales, 2020, 10(20): 1903110.
[11] XU Z L, CAO K, ABOUALI S, et al.Estudio de los mecanismos de litiación del Si recubierto de carbono de alto rendimiento. ánodos mediante microscopía in situ. Materiales de almacenamiento de energía, 2016, 3: 45.
[12] TEKI R, MONI K D, RAHUL K, et al. Ánodos de silicio nanoestructurados para Baterías recargables de iones de litio. Small, 2009, 5(20): 2236.
[13] XIA S X, ZHANG X, LUO L L, et al. Altamente estable y ánodo de metal de Li de tasa ultraalta habilitado por fibras de carbono fluoradas.Small, 2021, 17: 2006002.
[14] ZHANG S L, WANG X, HO K S, et al. Espectros Raman en un región de frecuencia amplia del silicio poroso tipo p. Journal of Applied Física, 1994, 76(5): 3016.
[15] HUANG W, WANG Y, LUO G H, et al.99,9% Pureza nanotubos de carbono de paredes múltiples por vacío recocido a alta temperatura. Carbono, 2003, 41(13): 2585.
[16] MCDOWELL M T, LEE S W, NIX W D, et al. 25º aniversario artículo: comprensión de la litiación del silicio y otros ánodos de aleación para Baterías de iones de litio. Materiales avanzados, 2013, 25(36): 4966.
[17] LLAVE B, MORCRETTE M, TARASCON J M.Análisis de la función de distribución de pares y estudios de RMN de estado sólido de silicio. Electrodos para baterías de iones de litio: comprensión de la (des)litiación. mecanismos .Journal of American Chemical Society, 2011, 133(3): 503.
[18] GAO H, XIAO L S, PLUMEL I, et al. Reacciones parasitarias en nanotamaño ánodos de silicio para baterías de iones de litio.Nano Letters, 2017, 17(3): 1512.
[19] CHEN J, FAN X L, LI Q, et al. Diseño de electrolitos para ricos en LiF Interfaces de electrolito sólido para permitir ánodos de aleación de microtamaño de alto rendimiento. para baterías.Nature Energy, 2020, 5(5): 386.
[20] ZHANG P, GAO Y Q, RU Q, et al.Preparación escalable de porosos Ánodo de nanosilicio/TiN@carbon para baterías de iones de litio.Superficie aplicada Ciencia, 2019, 498: 143829.
[21] SU M R, WAN H F, LIU Y J, et al.Multicapa Compuesto a base de Si recubierto de carbono como ánodo para baterías de iones de litio.Polvo Tecnología, 2018, 323: 294.
[22] PU J B, QIN J, WANG Y Z, et al. Síntesis de estructura de micronanoesferas. compuesto de silicio y carbono como material anódico para baterías de iones de litio. Cartas de Física, 2022, 806: 140006.
[23] GAO R S, TANG J, YU X L, et al. Un sándwich de silicio-carbono compuesto preparado mediante polimerización superficial para un rápido almacenamiento de iones de litio.
Nano Energía, 2020, 70: 104444.
[24] GONG X H, ZHENG Y B, ZHENG J, et al.Yema-cáscara compuestos de silicio/carbono preparados a partir de una aleación de aluminio-silicio como ánodo Materiales para baterías de iones de litio. Ionics, 2021, 27: 1939.
[25] LIA Y R, WANG R Y, ZHANG J W y otros Sandwich Estructura de ánodos de nanofibras de carbono/silicio recubiertos de carbono para iones de litio. baterías.Ceramics International, 2019, 45: 16195.
[26] YANG X M Y ROGACH A L.Técnicas electroquímicas en la investigación de baterías: un tutorial para no electroquímicos. Materiales energéticos avanzados, 2019, 9 (25): 1900747.