Gel de sal de litio dual Electrolito complejo: preparación y aplicación en batería de litio-metaly
GUO Yuxiang, HUANG Liqiang, WANG Gang, WANG Hongzhi. Complejo de gel dual de sal de litio Electrolito: Preparación y Aplicación en Batería de Litio-metal. Diario de Materiales inorgánicos, 2023, 38(7): 785-792 DOI:10.15541/jim20220761
Resumen
Metallic Li es uno de los ánodos ideales para iones de litio de alta densidad de energía. batería debido a su alta capacidad específica teórica, bajo potencial de reducción así como abundantes reservas. Sin embargo, la aplicación de ánodos de Li sufre de Incompatibilidad grave con el electrolito líquido orgánico tradicional. Aquí, un Electrolito complejo en gel (GCE) con compatibilidad satisfactoria con Li metálico. El ánodo se construyó mediante polimerización in situ. el doble El sistema de sal de litio introducido en el electrolito puede cooperar con el Componente polimérico, que amplía la ventana electroquímica del electrolito para 5,26 V frente a los 3,92 V del electrolito comercial, y obtiene un alto contenido iónico conductividad de 1Ã10-3 S·cm-1 a 30 ℃ también. Resultados de Caracterización morfológica y análisis elemental de la superficie del ánodo de Li. que GCE exhibe un efecto protector obvio sobre el metal de litio bajo la Condición del sistema doble de sales de litio y efecto de volumen y crecimiento de dendritas. del ánodo de Li están obviamente inhibidos. Al mismo tiempo, el metal de litio lleno batería, ensamblada con material catódico comercial de fosfato de hierro y litio (LiFePO4), exhibe una excelente estabilidad cíclica y rendimiento de velocidad. la capacidad La tasa de retención de la batería alcanza el 92,95 % después de 200 ciclos a una velocidad constante. corriente de 0,2C (1C = 0,67 mA·cm-2) a 25 ℃. Este estudio indica que la CME pueda mejorar eficazmente la seguridad, la estabilidad y la rendimiento electroquímico de la batería de litio-metal, que se espera que proporcionar una estrategia para el diseño universal de electrolitos cuasi sólidos.
Palabras claveï¼ Li metálico; polimerización in situ; complejo de gel electrolito
Desde que se puso el objetivo del “Doble Carbono” De cara a 2020, China se enfrenta a una reforma del sistema energético sin precedentes. Porcelana necesita completar una profunda reducción de las emisiones de carbono en los próximos 30 años, y la energía verde se irá fortaleciendo paulatinamente hasta sustituir al “monopolio” posición de la energía fósil tradicional. Como parte importante de las energías renovables sistema de energía, la tecnología de baterías de iones de litio ha atraído a una amplia atención una vez que salió. En la actualidad, además de ser el principal energético Dispositivo de productos electrónicos 3C, la aplicación de baterías de litio en el Los campos de la industria automovilística, aeroespacial y de redes inteligentes se están ampliando gradualmente. creciente, lo que impone mayores requisitos para su desempeño. En Para obtener una mayor autonomía de crucero, es necesario alimentar baterías de litio. Desarrollar un sistema de baterías con mayor densidad energética. Entre ellos, el litio metálico. con capacidad específica ultraalta (3860 mAh g-1) y bajo potencial de reducción Se espera que (-3,04 V (frente a SHE)) se convierta en el material del ánodo de la próxima generación. de baterías de alta densidad de energía. Sin embargo, cuando el metal litio está en contacto Con electrolitos líquidos orgánicos, las reacciones secundarias continúan ocurriendo en el interfaz, lo que lleva al crecimiento incontrolable de dendritas de litio, perforando la Separador interno de la batería, provocando cortocircuitos e incluso seguridad. asuntos. Como respuesta a este defecto, se suele considerar el uso de sólidos. electrolito en lugar de electrolito líquido para mejorar la seguridad de la batería. Sin embargo, su conductividad iónica a baja temperatura ambiente y su mala interfaz La compatibilidad obstaculiza seriamente su desarrollo y aplicación posteriores.
En este contexto, el estado de gel Electrolitos capaces de equilibrar los contactos interfaciales y la conductividad iónica. han recibido una atención cada vez mayor. Tan Shuangjie et al desarrollaron un Electrolito en estado de gel no inflamable mediante retardante de llama inmovilizador. organofosforados en una matriz polimérica de carbonato de polivinileno con alto resistencia mecánica. El electrolito tiene las ventajas de un alto contenido iónico. Conductividad y número de transferencia de iones de litio, no inflamabilidad, alta mecánica. Resistencia y buena compatibilidad electroquímica. Además, el gel El electrolito formado dentro de la batería por polimerización in situ tiene la características de baja viscosidad, fácil manejo y fuerte capacidad de humectación, que puede infiltrarse completamente en los materiales activos y producir una interfaz ideal contacto, obteniendo así una buena ruta de migración de iones. Por ejemplo, Guo Yuguo El grupo de investigación mezcló el monómero tradicional a base de éter 1,3-dioxolano (1,3-dioxolano, DOL) con 1,2-dimetoxietano (1,2-Dimetoxietano, DME), litio comercial El hexafluorofosfato (LiPF6) como sal de litio puede provocar la apertura del anillo. polimerización de DOL al mismo tiempo, y un nuevo electrolito en estado de gel que Puede funcionar de forma estable en baterías de litio-azufre y baterías catódicas comerciales. se ha obtenido. Aunque el polímero a base de poliéter es uno de los más estables electrolitos para ánodos de metal de litio, su estrecha ventana electroquímica y La baja conductividad iónica a temperatura ambiente limita su aplicación en alta energía. baterías de densidad. Aunque LiPF6 tiene una conductividad iónica ideal y una excelente compatibilidad del electrodo, tiene el problema de una mala estabilidad electroquímica. Por lo tanto, para desarrollar un electrolito en estado gel con excelente y completo rendimiento, es necesario seleccionar polímeros anfitriones adecuados, sales de litio y otros componentes.
Para equilibrar la relación entre conductividad, estabilidad de alto voltaje y compatibilidad de electrodos, un En este estudio se desarrolló GCE de alto rendimiento compuesto sólido-líquido. El Se adoptó el método de polimerización in situ iniciada térmicamente, se utilizó PEGDA como monómero, se utilizó un disolvente mixto de carbonato de etileno y carbonato de dietilo. Se agregaron, y LiTFSI y LiDFOB se introdujeron como el sistema doble de sal de litio. para trabajar junto con los componentes poliméricos. Mientras se mejora la Rendimiento electroquímico, la estabilidad de la interfaz entre el electrolito. y el ánodo de metal de litio se mejora aún más.
1 Método experimental
1.1 Preparación de GCE
LiTFSI, LiDFOB, EC y DEC (Suzhou Duoduo Chemical Technology Co., Ltd.) son todos materiales para baterías de grado anhidro. El Se mezclaron los reactivos EC y DEC, y se pesaron y pesaron LiTFSI y LiDFOB. disuelto en el disolvente. El electrolito del sistema de doble sal preparado (líquido Electrolito, LE) era una solución EC/DEC (relación de volumen 1: 1) de 1 mol/L de LiTFSI. y 0,2 mol/l de LiDFOB. PEGDA (â¥99%, Mn=400) y azobisisobutironitrilo (Azodiisobutironitrilo, AIBN, 98%) se adquirieron de Shanghai Aladdin Reagent Co., Ltd. La solución precursora de GCE se preparó mezclando PEGDA y LE, y la fracción de masa de PEGDA fue 10%, 20% y 30%. Añadir 1% de fracción de masa de iniciador térmico AIBN y revuelva bien. La solución precursora de PEGDA se calentó a 70 °C durante 2 h para obtener un compuesto de gel a base de PEGDA totalmente polimerizado electrolitos, que fueron denominados GCE-x (x=10, 20, 30). Los experimentos anteriores fueron todo realizado en una guantera anhidra y libre de oxígeno.
1.2 Montaje de la batería
Conjunto de batería de pila de botón CR2025 (316 acero inoxidable, SS), chapa de litio (14 mmÃ0,45 mm, Li), papel de aluminio (grado de batería). Según diferentes requisitos de prueba, baterías SS||SS, Las baterías Li||SS, Li||Li y Li||LiFePO4 se ensamblaron en la guantera. La relación de masa de LiFePO4, Ketjen Black y polivinilideno. El difluoruro (PVDF) en el material del cátodo es 90: 5: 5 y la capacidad real es de 0,67 mAh·cm-2. Consulte el Material complementario S1 para obtener detalles sobre la preparación. proceso de la lámina del electrodo positivo y el proceso de ensamblaje de la batería.
1.3 Métodos de caracterización de materiales
Los grupos funcionales y químicos. Las estructuras de los monómeros PEGDA y sus polímeros se analizaron utilizando un termo. Espectrómetro infrarrojo por transformada de Fourier NiColet iS50 (transformada de Fourier) Espectrómetro infrarrojo, FT-IR) de Thermo Fisher Scientific Corporation del Estados Unidos, con un rango de longitud de onda de 400-4000 cm-1. La cristalinidad de Los electrolitos en estado de gel con diferentes contenidos de polímeros se caracterizaron por un difractómetro de rayos X D2 Phaser (difractómetro de rayos X, XRD) de Bruker AXS Company, Alemania, y el rango de escaneo fue de 2θ=5°~80°. El contacto OCA40Micro El instrumento de medición de ángulos de Beijing Dongfang Defei Instrument Co., Ltd. fue Se utiliza para probar el ángulo de contacto de soluciones precursoras con diferentes PEGDA. contenido en la superficie de la lámina del electrodo LiFePO4. La morfología microscópica de la sección transversal y la superficie de la lámina de metal de litio se observó mediante un Microscopio electrónico de barrido de emisión de campo JElectronics JSM-7500F (campo Microscopio Electrónico de Barrido de Emisiones, FESEM). La información elemental sobre el La superficie de la lámina de metal de litio se analizó utilizando un equipo de rayos X Escalab 250Xi. espectrómetro fotoelectrónico (espectroscopia fotoelectrónica de rayos X, XPS) de Thermo Fisher Scientific Corporation de los Estados Unidos.
1.4 Prueba electroquímica
La ventana de estabilidad electroquímica del El electrolito se probó mediante voltamperometría de barrido lineal (LSV), el rango de voltaje fue desde voltaje de circuito abierto (OCV) a 6 V, y la velocidad de barrido fue de 1 mV·s-1. El el rango de frecuencia de la espectroscopia de impedancia electroquímica (EIS) es de 10-2 ~ 106 Hz, y el voltaje de perturbación es de 10 mV. Se utilizó cronoamperometría para medir el número de migración de iones de litio en el electrolito, el potencial La diferencia se estableció en 10 mV, el tiempo fue de 800 s y el número de migración de iones de litio se obtuvo según la fórmula (1):
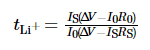
Entre ellos, tLi+ es el número de transferencia de iones de litio, ÎV es la diferencia de potencial, R0 y RS son la interfaz valores de impedancia del electrodo y electrolito antes y después de la prueba, respectivamente, y I0 e IS son la corriente del estado inicial y el estado estable. actual, respectivamente. Todas las pruebas anteriores se llevaron a cabo en el PARSTAT MC. Estación de trabajo electroquímica multicanal de AMETEK, EE. UU. El rendimiento del ciclo de carga-descarga de La batería se probó utilizando la plataforma de prueba de baterías LAND CT3001A-1U de Wuhan. Landian Electronics Co., Ltd.
2 Resultados y discusión
2.1 Preparación y análisis estructural de CME
En este estudio, se utilizó PEGDA como monómero, Se utilizó AIBN como iniciador de polimerización y se introdujeron EC y DEC como plastificantes. Un electrolito en estado de gel con un polímero reticulado. El dimetacrilato de polietilenglicol (p (PEGDA)) se sintetizó a 70 °C. El La fórmula de la reacción de polimerización se muestra en la Figura 1 (a). Después de agregar el iniciador térmico AIBN, PEGDA con dos grupos C = C terminales activos rápidamente sufre homopolimerización intermolecular cuando se calienta a 70 °C. el activo Las cadenas de AIBN hacen que las cadenas moleculares se conecten entre sí o internamente, y finalmente obtener la estructura del esqueleto de la red p(PEGDA), y exitosamente Utilice el método de polimerización in situ para obtener el electrolito en estado de gel. dentro de la batería. Como se muestra en la Figura S1, las tres soluciones precursoras con Diferentes contenidos de PEGDA mostraron una buena humectabilidad en el LiFePO4 positivo. lámina de electrodo, que es la clave para obtener un buen contacto interfacial entre el electrolito y el electrodo.
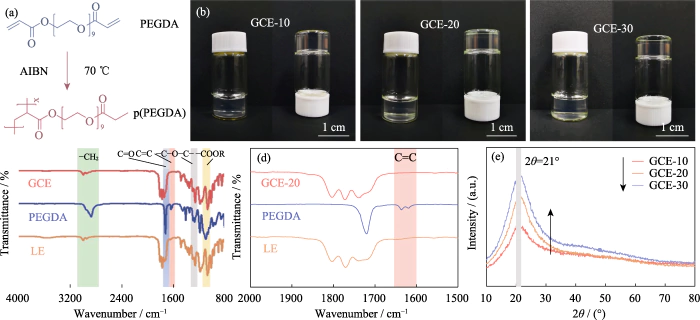
Fig. 1 Preparación y análisis estructural de GCE
(a) Polimerización reacción de PEGDA; (b) Fotografías ópticas de GCE-x; (c, d) FT-IR espectros de GCE-20, PEGDA y LE; (e) patrones XRD de GCE-x; Vistoso las cifras están disponibles en el sitio web
Para obtener GCE con alto contenido iónico conductividad, LiTFSI, que tiene un alto grado de disociación en el polímero, se usó como sal de litio y se introdujo LiDFOB 0,2 mol/l para construir la red de gel del sistema de doble sal. LiDFOB tiene buena solubilidad y Estabilidad térmica, especialmente en las propiedades filmógenas. cuando carbonato Los disolventes están en contacto con los ánodos de metal de litio, una gran cantidad de partículas sueltas Es probable que se formen capas de deposición de litio porosas o dendríticas en la superficie. superficie del metal litio. La introducción de LiDFOB puede ayudar en la formación de una interfase de electrolito sólido libre de HF (Solid Electrolyte Interfase, SEI) y mejora la compatibilidad con ánodos de metal de litio. Al mismo tiempo, LiTFSI tiene un efecto corrosivo en los colectores de corriente metálicos, Mientras que LiDFOB puede pasivar el metal de aluminio y aliviar el efecto de corrosión de LiTFSI sobre coleccionistas actuales. Sin embargo, el electrolito monosal de LiDFOB exhibió una impedancia más alta que el electrolito de doble sal LiTFSI-LiDFOB del misma concentración. Como se muestra en la Figura S2, la batería Li||LiFePO4 fue ensamblado usando electrolitos de gel LiDFOB y LiTFSI-LiDFOB de 1,2 mol/L, respectivamente, y la impedancia de la batería LiTFSI-LiDFOB fue significativamente más pequeño.
Los resultados de las investigaciones existentes muestran que LiTFSI y LiDFOB puede tener un efecto sinérgico, mejorando eficazmente la compatibilidad del electrolito con el ánodo de metal litio. Jiao Shuhong y Alabama. utilizó XPS y FT-IR para descubrir que el electrolito de doble sal de LiTFSI y LiDFOB puede pasivar el colector de corriente de aluminio del electrodo positivo y formar una capa SEI estable en la superficie del metal de litio negativo Electrodo para lograr un ciclo estable a largo plazo de baterías de metal de litio. En Sobre esta base, Liu Yue et al. [26] utilizó simulación de dinámica molecular híbrida para estudiar el mecanismo de acción conjunto de LiTFSI y LiDFOB en litio metálico baterías y explicó el efecto protector de LiTFSI en LiDFOB. Estudios han demostrado que el enlace B-O de LiDFOB es relativamente el más débil y propenso a rotura. LiDFOB se descompondrá rápidamente bajo la acción de los radicales libres y reacciona con litio metálico para producir átomos libres de LiO y boro. El átomo de boro La reacción de inserción hace que las moléculas de disolvente en el electrolito se descomponerse, y los fragmentos moleculares resultantes continuarán reaccionando con fragmentos moleculares de sal de litio y átomos de boro. En el sistema de sales de dilitio, sin embargo, LiTFSI se descompone preferentemente, confiando en el "sacrificio Mecanismo" para proteger LiDFOB, la tasa de descomposición de LiDFOB es significativamente reducido. Reduciendo así el número de átomos de Li0 y boro libres, que puede optimizar la capa SEI y proteger el ánodo de metal de litio.
Como se muestra en la Figura 1(b), GCE-x es uniforme y transparente, gelatinoso, ya no fluido. Para verificar más a fondo el monómero polimerización, se utilizó FT-IR para caracterizar las estructuras químicas de LE, Monómero PEGDA y GCE-20. Como se muestra en la Fig. 1 (c), las tres muestras muestran la pico de absorción típico de vibración de estiramiento C=O (~1726 cm-1). El El pico de absorción a 1280 cm-1 de GCE corresponde al antisimétrico y picos de estiramiento simétrico del enlace éter, lo que indica que -(CH2CH2)n- en el monómero no se destruye durante la polimerización. Los picos en 1095 y 2867 cmâ1 pertenecen a -COOR y -CH2, respectivamente. Como Como se muestra en la Figura 1 (d), el pico característico del enlace C = C de PEGDA es ubicado en 1616-1636 cm-1, pero desaparece en GCE, lo que indica que PEGDA tiene ha sido polimerizado completamente.
Dado que los iones de litio migran sólo en el región amorfa de GCE, la reducción de la cristalinidad del electrolito es beneficioso para mejorar la conductividad iónica. La Figura 1 (e) es el patrón XRD de CME-x. Los tres tipos de muestras tienen un pico de absorción de difracción único. a 2θ=21°, lo que indica que el electrolito preparado tiene una región amorfa acompañado de una pequeña cantidad de cristalitos. Como el contenido de PEGDA aumenta, el área del pico del espectro aumenta significativamente, el La proporción de la región amorfa del electrolito en gel disminuye y la El contenido de componentes amorfos en el electrolito disminuye, lo que no es propicio para la migración de iones.
2.2 Rendimiento electroquímico de GCE y Análisis de compatibilidad de metales Li
Para estudiar la compatibilidad de electrolitos con diferentes contenidos de polímeros con ánodos de metal de litio en Baterías, espectros de impedancia de baterías Li||Li simétricas con GCE-x. Se analizaron los electrolitos en el estado inicial (como se muestra en la Figura S3). En el En la figura, los valores de impedancia de interfaz de las baterías GCE-10 y GCE-20 son ambas pequeñas, de 93 y 152 Ω, respectivamente, y la batería GCE-30 alcanza los 409 Ω. Muestra que la migración de iones de litio en GCE con mayor contenido de polímero necesita superar una barrera migratoria mayor, que no favorece la rápida conducción de iones de litio en la interfaz.
Observando el sobrepotencial del Li||Li batería simétrica en la prueba del ciclo de carga-descarga, podemos conocer el potencial diferencia generada por la migración del par iónico durante este proceso, y luego evaluar el comportamiento de deposición/extracción del litio. La Figura S4 muestra la Curvas voltaje-tiempo de la celda simétrica Li||Li de GCE-x. La temperatura de prueba era de 25 °C y la batería se cargaba y descargaba bajo una corriente constante con una capacidad específica de 0,5 mAh cm-2 y una densidad de corriente de 0,5 mA cm-2. El sobrepotencial inicial de las celdas Li|GCE-10|Li fue de 22 mV y el voltaje aumentó a 137 mV después de 250 h. El sobrepotencial del GCE-30 simétrico La batería era de 104 mV en la etapa inicial y el sobrepotencial aumentó rápidamente en los ciclos posteriores, alcanzando un valor máximo de 509 mV en 227 h y luego cayó bruscamente, lo que indica que la batería tenía un cortocircuito interno. En Por el contrario, la batería GCE-20 puede funcionar a un sobrepotencial bajo cercano a 30 mV, y Tiene el rendimiento electroquímico más estable. Lo siguiente se centrará en el electrolito GCE-20.
La conductividad iónica de un electrolito. Refleja directamente la capacidad de los iones para migrar en un campo eléctrico. El La conductividad iónica de LE y GCE-20 se probó a 60, 50, 40, 30, 20, 10 y 0. â, respectivamente. Como se muestra en la Figura 2 (a), la conductividad iónica de GCE-20 en 30 °C es 1,00 mS cm-1, y cuando la temperatura de prueba aumenta a 60 °C, la la conductividad alcanza 1,39 mS cm-1. Esto se debe a que la energía de activación disminuye con el aumento de la temperatura de prueba y la actividad de movimiento de Los segmentos de cadena polimérica y los iones de litio aumentan. Sin embargo, la velocidad del movimiento de los segmentos de la cadena polimérica se ve obviamente afectada por la temperatura, por lo que la La conductividad del electrolito en gel GCE-20 cambia más que la del electrolito. solución.
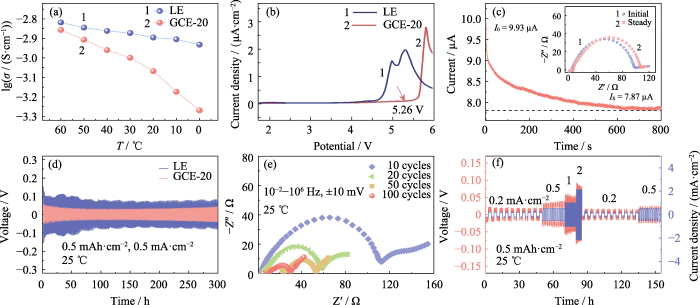
Fig. 2 Rendimiento electroquímico de GCE-20
(a) iónico conductividades de LE y GCE-20; (b) curvas LSV de LE y GCE-20; (do) Perfil de tiempo actual de Li|GCE-20|Li celda con un recuadro que muestra las correspondientes Tramas de Nyquist; (d) Curvas voltaje-tiempo de celdas simétricas Li||Li ensambladas con LE y GCE-20; (e) Gráficos de Nyquist de células Li|GCE-20|Li después del ciclo; (F) Curvas tensión-tiempo y densidad de corriente-tiempo de celda Li|GCE-20|Li; Vistoso las cifras están disponibles en el sitio web
Mejora de la densidad energética de las baterías Requiere garantizar la estabilidad del electrolito a altos voltajes de funcionamiento. Los estudios han demostrado que los electrolitos basados en polímeros coordinados por carbonilo generalmente Tienen una amplia ventana electroquímica y buena estabilidad a altas temperaturas de funcionamiento. voltajes. La Figura 2 (b) muestra que la curva LSV de la batería GCE-20 comienza a fluctúan significativamente a 5,26 V, y se puede considerar que el La ventana electroquímica del electrolito de gel GCE-20 alcanza 5,26 V. En Por el contrario, la ventana electroquímica del electrolito comercial es sólo 3,92 V. Por lo tanto, el electrolito en estado gel tiene una excelente estabilidad electroquímica. a alto voltaje.
Además, la migración de iones de litio El número del electrolito también es uno de los indicadores para medir el litio. conductividad iónica. Se define como la relación entre el número de iones de litio. pasando a través de una sección del electrolito perpendicular a la dirección de Migración de iones de litio por unidad de tiempo a la suma de aniones y cationes que pasan. a través de la sección. Cuanto mayor sea el valor, mayor será la proporción de litio. iones en el proceso de migración de iones y mayor será la eficiencia de la migración. La Figura 2 (c) es la curva de cronoamperometría de la batería Li|GCE-20|Li, donde el recuadro es la comparación de la impedancia electroquímica de la batería antes y después de la prueba. Según la fórmula (1), el número de migración de iones de litio de GCE-20 es 0,21. La introducción de aditivos o dopaje con sustancias inorgánicas. Los rellenos pueden obtener una mayor tasa de migración de iones de litio, lo que no solo es beneficioso para mejorar la tasa de carga y descarga de la batería, pero también mejorar la estabilidad de su ciclo.
Durante el proceso de carga y descarga de Li||Li batería simétrica, los aniones y cationes en el electrolito se someten contramigración. Al cargar, los iones de litio migran al negativo. electrodo, y los aniones migran al electrodo positivo, y ocurre lo contrario. cierto al descargar. Por lo tanto, durante el proceso de carga y descarga, el gradiente de concentración de iones entre los electrodos positivo y negativo y El campo eléctrico incorporado aumenta gradualmente, dificultando el movimiento opuesto. de aniones y cationes, lo que resulta en una polarización de la concentración dentro del batería, lo que resulta en un cambio en el sobrepotencial. Como se muestra en la Figura 2(d), el Li|GCE-20|La batería de Li tiene un sobrepotencial de 46 mV después de un ciclo estable durante 300 h. Sin embargo, el sobrepotencial generado por la batería Li|LE|Li durante la prueba es significativamente mayor que el de la batería Li|GCE-20|Li (65~118 mV). Este se debe a que las dendritas de litio en crecimiento provocan cortocircuitos suaves en algunos sitios internos. Los resultados muestran que el comportamiento electroquímico dentro del La batería GCE-20 es más ideal. La Figura 2 (e) es la prueba EIS del sistema simétrico. batería después de 10, 20, 50 y 100 ciclos. Como el número de carga-descarga. A medida que aumentan los ciclos, la impedancia de la batería tiende a disminuir. Durante este proceso, Se construyó una capa SEI estable entre el electrolito y el litio metálico. interfaz, y el contacto de la interfaz se optimizó, de modo que la interfaz la impedancia disminuyó significativamente.
A 25 °C, la batería Li|GCE-20|Li estaba sometido a 10 ciclos de carga-descarga a densidades de corriente de 0,2, 0,5, 1, 2, 0,2 y 0,5 mA cm-2, respectivamente. La figura 2(f) refleja la tendencia de la sobrepotencial de la celda simétrica a lo largo del tiempo durante este proceso. El El sobrepotencial a baja densidad de corriente es pequeño y puede permanecer relativamente estable. Después de que aumenta la densidad de corriente, el sobrepotencial aumenta en consecuencia, y no hay aumento/disminución repentina de voltaje durante el proceso.
La morfología del revestimiento de láminas de litio. después del ciclo puede caracterizar visualmente el comportamiento de deposición/extracción de Litio dentro de la batería. La batería simétrica Li||Li fue desmontada después cargando y descargando durante 100 h con una capacidad de 0,5 mAh cm-2 y una corriente densidad de 0,5 mA cm-2, y la morfología microscópica de la sección transversal y FESEM observó la superficie de la lámina de metal de litio. Como se muestra en la figura 3(a, b), el espesor de la lámina de litio prístina sin tratar es de 353 µm, y la superficie es plana y lisa. La interacción entre el electrolito líquido y El metal litio conduce a la deposición de una gran cantidad de partículas sueltas y porosas. capas de deposición de litio en la superficie de la lámina de litio del Li|LE|Li batería, en su mayoría en forma de musgo fino y desigual. Cuando el espesor de la La lámina de metal de litio aumenta a 446 µm, hay una expansión de volumen obvia. efecto, y se genera una gran cantidad de dendritas. En contraste, el El espesor de la lámina de litio en la batería Li|GCE-20|Li es de 391 μm, y el La capa de deposición superficial es densa y uniforme, y no hay finamente dividida. revestimiento de litio (Fig. 3(c)). Muestra que el electrolito en estado gel puede Suprime eficazmente la expansión del volumen del ánodo de metal de litio. LiDFOB en GCE-20 puede ayudar en la formación de una capa SEI estable para equilibrar el interior potencial de la batería y retrasar el crecimiento de dendritas de litio al inducir Deposición uniforme de litio. Por lo tanto, hasta cierto punto, puede optimizar el comportamiento de deposición/extracción de litio y proteger el ánodo de metal de litio.

Fig. 3 Imágenes SEM de Li metálico
Transversal (arriba) e imágenes SEM de vista superior (abajo) de (a) deposición de litio y Li metálico fresco Morfología en células Li||Li simétricas con (b) LE y (c) GCE-20
Posteriormente, análisis de elementos de superficie XPS. se utilizó para explorar la composición de la capa SEI en la superficie del Ánodo de metal de litio bajo la acción del sistema de doble sal LiTFSI-LiDFOB CME. La Figura S5 es el espectro XPS de la superficie del ánodo de metal de litio usando LE y CME-20. El espectro de C1 (Fig. S5 (a, d)) tiene principalmente 4 picos de señal, correspondiente a C-C/C-H a 284,8 eV. Los dos picos en 286,4 y 289,4 eV corresponden a C-O y C=O, respectivamente, y se derivan principalmente de la productos de descomposición de disolventes carbonatados (como ROCO2-, ROC-, etc.). El El pico a 292,7 eV corresponde al CF3, que se deriva principalmente del Productos de descomposición de las sales de litio. En el espectro O1 (Figura S5 (b, e)), los picos a 531,1 y 532,3 eV corresponden a C=O y C-O, respectivamente, y el contenido relativo de CO se reduce significativamente, lo que está relacionado principalmente a la disminución del contenido de productos de descomposición. debajo de la articulación acción de LiTFSI y LiDFOB, la formación de LiOCH3, Li2O2C2H4 y otros subproductos está restringido. Ademásción, a diferencia de LE (Fig. S5 (e)), en los F1 espectro de GCE-20 (Fig. S5 (f)), el pico de señal de LiF está en 684,5 eV y LiF puede ayudar en la formación de una capa SEI densa y estable.
2.3 Análisis del rendimiento electroquímico de Li||Batería LiFePO4
LiFePO4 tiene las ventajas de un alto capacidad, ciclo de vida prolongado y seguridad excepcional, y es un aspecto positivo Material activo del electrodo. Su capacidad específica teórica es de 170 mAh·g-1. En 25 °C, la batería Li|GCE-20|LiFePO4 se cargó y descargó 200 veces a la vez. corriente constante de 0,2C (1C=0,67 mA·cm-2). Como se muestra en la Figura 4(a, b), el La capacidad específica de descarga del primer ciclo es de 141,4 mAh·g-1. la descarga La capacidad específica de la vuelta 200 es 131,4 mAh·g-1, la retención de capacidad La tasa alcanza el 92,95% y la caída de capacidad de una sola vuelta es inferior al 0,04%. El El voltaje de la plataforma es estable, de acuerdo con las características de LiFePO4. baterías. Eficiencia coulómbica, como indicador importante para evaluar la batería Estabilidad del ciclo, se refiere a la relación entre la capacidad de descarga y la carga de la batería. capacidad durante el mismo ciclo. La eficiencia coulombiana del primer ciclo del La batería Li|GCE-20|LiFePO4 es del 97,8%. Debido a la formación de la capa SEI Durante el proceso de descarga del primer ciclo, parte de la capacidad irreversible es generado, lo que resulta en una baja eficiencia coulómbica del primer ciclo.
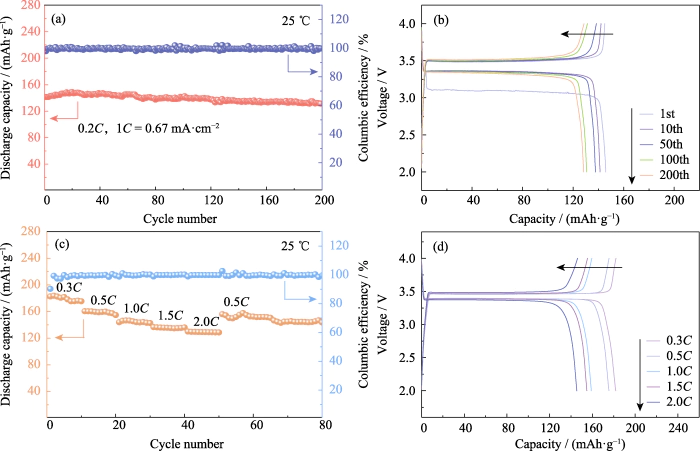
Fig. 4 Rendimiento electroquímico del Li|GCE-20|Células LiFePO4
(a) Ciclismo rendimiento y (b) las curvas de tensión-capacidad correspondientes a 0,2 C; (do) Desempeño de tarifas y (d) curvas de voltaje-capacidad correspondientes; Vistoso las cifras están disponibles en el sitio web
Además, pruebas de carga y descarga. se realizaron en Li|GCE-20|LiFePO4 a una velocidad de 0,3 °C, 0,5 °C, 1 °C, 1,5 °C y 0,5 °C. corrientes para explorar su comportamiento de velocidad. Como se muestra en la Fig. 4(c), cuando el La tasa actual es de 0,5 C, la capacidad específica de descarga del primer ciclo del La batería es de 160,2 mAh·g-1. A medida que aumenta la tasa actual, la descarga específica La capacidad de la batería disminuye dentro de un rango controlable. La tasa es aumentado a 2C, y la capacidad específica del primer ciclo del costo es 130 mAh·g-1. Posteriormente, la tasa actual volvió a 0,5°C y el La capacidad específica de descarga del primer ciclo fue de 156,1 mAh·g-1. lo relevante Las curvas de voltaje-capacidad se muestran en la Figura 4 (d). El voltaje de meseta en diferentes tasas es estable sin causar un aumento en el sobrepotencial, y la La batería muestra un buen rendimiento y reversibilidad.
3 Conclusión
GCE basado en PEGDA fue desarrollado térmicamente iniciando la polimerización in situ. El análisis de caracterización FT-IR y XRD. de GCE, combinado con pruebas electroquímicas, descartó el GCE óptimo formulación. Ensamble aún más la batería para estudiar la electroquímica. rendimiento del electrolito y analizar el efecto protector del electrolito en el electrodo negativo de metal litio observando la Morfología microscópica y caracterización de elementos superficiales del metal litio. explicando:
1) El GCE-x (x=10, 20, 30) preparado por La polimerización in situ puede humedecer bien la lámina del electrodo y el electrolito. tiene la mejor estabilidad electroquímica cuando la fracción de masa de PEGDA es del 20%.
2) El sistema de sal de dilitio de LiTFSI y Se introduce LiDFOB, que puede formar una buena interacción con el polímero. componentes. El electrolito tiene una amplia ventana electroquímica (5,26 V) y alta Conductividad iónica (30 â, 1Ã10-3 S·cm-1). Al mismo tiempo, la sal de dilitio El sistema se puede utilizar para construir una capa SEI estable y proteger eficazmente el Ánodo de metal de litio.
3) Uso de GCE-20 para igualar el comercial Material del cátodo LiFePO4, la batería completa ensamblada puede cargarse de manera estable y Descarga durante 200 ciclos a una corriente de 0,2 C, con una tasa de retención de capacidad. del 92,95% y muestra un buen desempeño tarifario.
En resumen, este trabajo obtuvo un resultado seguro y Excelente rendimiento electroquímico de GCE, que proporciona un eficaz solución para el desarrollo de litio de alta densidad de energía seguro y estable baterías de metal.
Material adicional:
Proceso de preparación de la batería S1
Mezclar y moler LiFePO4, Ketjen Black y PVDF según la proporción objetivo, añadir el disolvente N-metilpirrolidona (N-Metilpirrolidona, NMP), agitar y dispersar completamente, y obtener una mezcla uniforme y suspensión viscosa de material activo. La lechada se recubrió mediante raspado sobre el aluminio. papel de aluminio con una recubridora plana, luego se transfirió a un horno de vacío y se secó a 80 °C durante 12 h. Después de cortar la lámina del electrodo, séquela nuevamente y transfiérala a un guantera anhidra y libre de oxígeno.
Una junta, metralla y chapa de litio. se colocaron en el centro de la caja del electrodo negativo en secuencia, y el El espesor de la lámina de metal de litio fue de 0,35 mm. Posteriormente, el precursor Se añadió gota a gota una solución de GCE en el centro de la superficie del negativo. electrodo (50 µL) usando una pistola de pipeta, y luego la batería Celgard 2500 separador y la lámina del electrodo positivo (separador de batería Celgard 2500) fueron colocados en secuencia. Antes de ensamblar la batería Li||LiFePO4, el Se pesó la pieza polar positiva y se registró la carga de material activo. La carga superficial del material activo del electrodo positivo LiFePO4 fue de 3,94 mg cm-2. Finalmente, presurice y selle la batería en una máquina selladora de baterías, transferirlo a un ambiente de 70 °C y calentarlo durante 2 h para iniciar polimerización para obtener un electrolito en estado de gel. Para garantizar que el electrolito se infiltra completamente en la pieza polar LiFePO4, la batería necesita ser dejar reposar durante 1 h después del montaje.
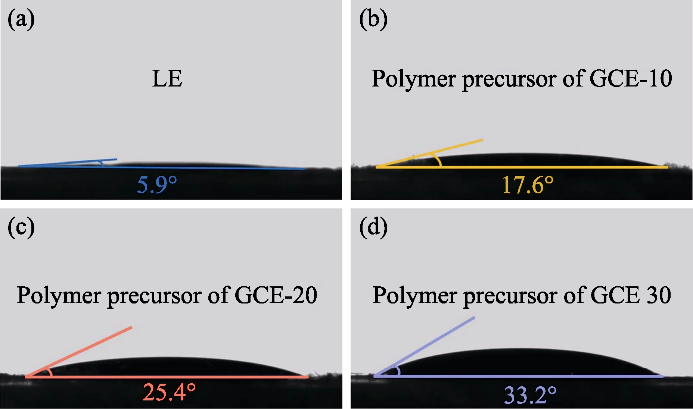
Fig. S1 Ángulos de contacto entre la solución precursora de polímero y los cátodos
(a) LE; b) CME-10; c) CME-20; (d) CME-30
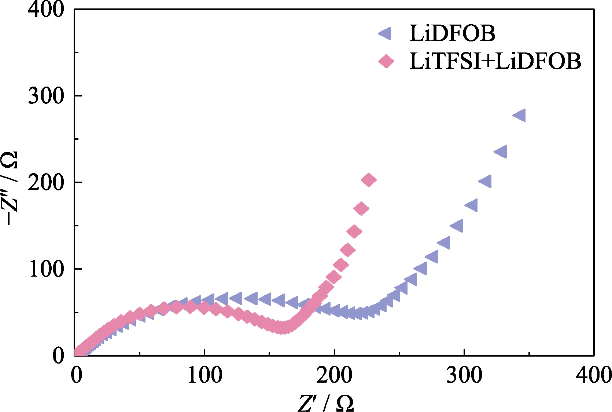
Fig. S2 Gráficos de Nyquist de células de Li||LiFePO4 ensambladas por GCE con diferentes sales de litio
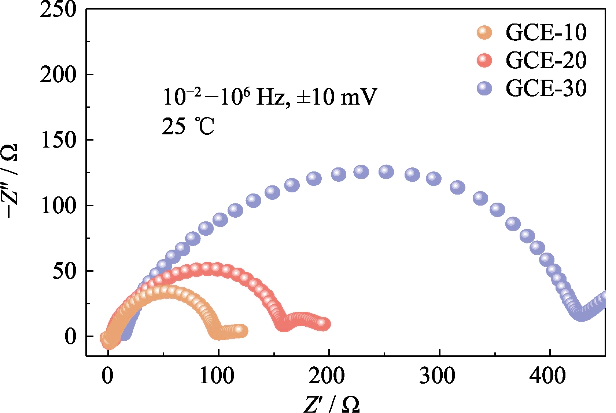
Fig. S3 Gráficos de Nyquist de células Li||Li simétricas ensambladas con electrolitos GCE-x
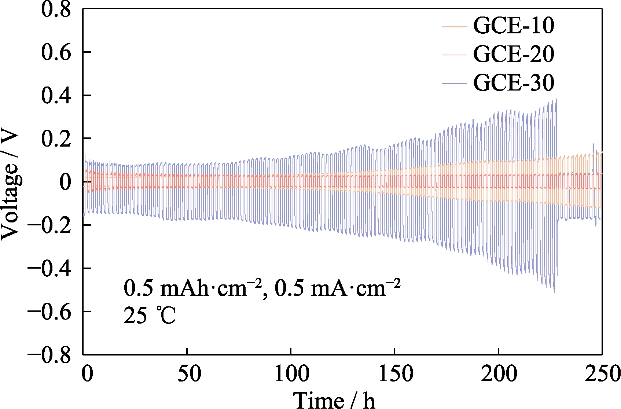
Fig. S4 Vperfiles de voltaje-tiempo de células Li||Li simétricas ensambladas con electrolitos GCE-x
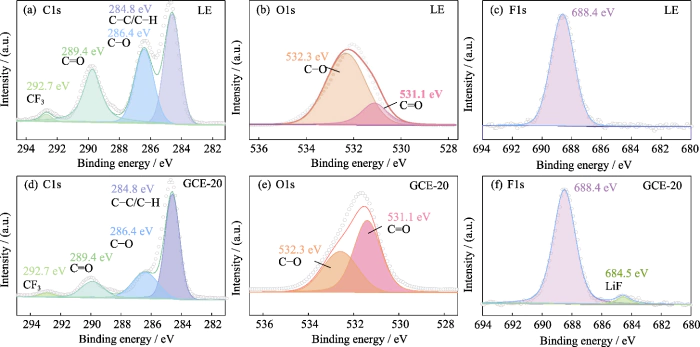
Fig. S5 XEspectros PS de ánodo de Li metálico en Li simétrico||Células de Li
(a, d) C1s, (b, e) O1s, (c, f) F1s Espectros XPS de ánodo metálico de Li con (a-c) LE y (d-f) GCE-20
[1] SUFICIENTEMENTE BUENO J B, KIM Y.
Desafíos para baterías de litio recargables
química de Materiales, 2010, 22(3):587.
[2] ZHAO J, LIAO L, SHI F, et Alabama.
Fluoración de superficie de materiales reactivos del ánodo de la batería para una mayor estabilidad
Diario del Sociedad Química Estadounidense, 2017, 139(33):11550.
[3] TARASCÓN J M, ARMAND M.
Problemas y desafíos frente a baterías de litio recargables
Naturaleza, 2001, 414(6861):359.
[4] ZHI J, YAZDI A Z, VALAPPIL G, et al.
Sólido artificial interfase de electrolitos para sistemas acuosos de almacenamiento de energía de litio
Avances científicos, 2017, 3(9):e1701010.
[5] JUN K, SUN Y, XIAO Y, et otros
Litio superiónico Conductores con estructuras que comparten esquinas
Materiales naturales, 2022, 21: 924.
[6] LIU J, BAO Z, CUI Y, et otros
Vías para prácticas baterías de litio metálico de ciclo largo y alta energía
Energía natural, 2019, 4(3):180.
[7] DUNN B, KAMATH H, TARASCON J
Energía eléctrica Almacenamiento para la red: una batería de opciones
Ciencia, 2011, 334(6058):928.
[8] MAUGER A, JULIEN C M, PAOLELLA A, et al.
Construyendo mejor baterías en estado sólido: una revisión
Materiales, 2019, 12(23):3892.
[9] MANTHIRAM A, YU X, WANG S.
Batería de litio químicas habilitadas por electrolitos de estado sólido
Reseñas de naturaleza Materiales, 2017, 2(4):16103.
[10] ZHOU D, SHANMUKARAJ D, TKACHEVA A, et otros
Electrolitos poliméricos para baterías de litio: avances y perspectivas
Chem, 2019, 5(9):2326.
[11] BRONCEADO J, YUE J, TIAN Y F, et al.
Encapsulación in situ de fosfato retardante de llama en una matriz polimérica robusta para baterías de metal de litio de estado casi sólido seguras y estables
Almacenamiento de energía Materiales, 2021, 39: 186.
[12] ZHAO Q, LIU X, STALIN S, et otros
Polímero de estado sólido Electrolitos con transporte interfacial rápido incorporado para litio secundario. baterías
Energía natural, 2019, 4(5):365.
[13] ZHOU Z, FENG Y, WANG J, et otros
Un robusto, altamente Piel extensible conductora de iones para baterías estables de metal de litio
Ingeniería Química Diario, 2020, 396: 125254.
[14] WILKEN S, TRESKOW M, SCHEERS J, et otros
Etapas iniciales de Descomposición térmica de electrolitos de baterías de iones de litio basados en LiPF6 mediante Raman y RMN detallados. espectroscopia
Avances de RSC, 2013, 3(37):16359.
[15] LIU F Q, WANG W P, YIN Y X, et al.
Actualización tradicional Electrolito líquido mediante gelificación in situ para el futuro litio baterías de metal
Avances científicos, 2018, 4(10):eaat5383.
[16] XU C, SUN B, GUSTAFSSON T, et otros
Capa de interfaz Formación en baterías de litio con electrolitos de polímero sólido: un estudio XPS
Diario de materiales Química A, 2014, 2(20):7256.
[17] WEI Z, CHEN S, WANG J, et otros
Iones de litio superiores conducción de electrolito polimérico con estructura en forma de peine a través de sin disolventes copolimerización para batería de litio bipolar de estado sólido
Diario de materiales Química A, 2018, 6(27):13438.
[18] DI NOTO V, LAVINA S, GIFFIN G A, et al.
Electrolitos poliméricos: presente, pasado y futuro
Electrochimica Acta, 2011, 57(15):4.
[19] XUE Z, HE D, XIE X.
Poli(etileno electrolitos a base de óxido) para baterías de iones de litio
Diario de materiales Química A, 2015, 3(38):19218.
[20] MINDEMARK J, LACEY M J, BOWDEN T, et al.
Más allá de PEO-Materiales anfitriones alternativos para electrolitos de polímero sólido conductores de Li+
Progreso en polímero Ciencia, 2018, 81: 114.
[21] ARAVINDAN V, GNANARAJ J, MADHAVI S, et otros
Iones de litio sales electrolíticas conductoras para baterías de litio
Chemistry-A European Journal, 2011, 17(51):14326.
[22] XU K.
Electrolitos y Interfaces en baterías de iones de litio y más
Revisiones de productos químicos, 2014, 114(23):11503.
[23] YANG H, ZHUANG G V, ROSS JR P N.
Estabilidad térmica de Batería LiPF6 de sal y Li-ion electrolitos que contienen LiPF6
Diario de poder Fuentes, 2006, 161(1):573.
[24] LI Q, LIU G, CHENG H, et otros
Baja temperatura Diseño de electrolitos para baterías de iones de litio: perspectivas y desafíos.
Química-Un europeo Diario, 2021, 27(64):15842.
[25] JIAO S, REN X, CAO R, et otros
Ciclo estable de baterías de metal de litio de alto voltaje en electrolitos de éter
Energía natural, 2018, 3(9):739.
[26] LIU Y, YU P, SUN Q, et otros
Operando previsto polimerización en el ánodo de litio mediante inserción de boro
Cartas de energía de la ACS, 2021, 6(6):2320.
[27] CAO W, LU J, ZHOU K, et otros
Orgánico-inorgánico SEI compuesto para un ánodo metálico de Li estable mediante polimerización in situ
Nano Energía, 2022, 95: 106983.
[28] CHENG S, SMITH D M, LI C Y.
¿Cómo funciona la nanoescala? ¿La estructura cristalina afecta el transporte de iones en electrolitos de polímeros sólidos?
Macromoléculas, 2014, 47(12):3978.
[29]JOHANSSON P.
Primeros principios Modelado de electrolitos de polímeros amorfos: complejos Li+-PEO, Li+-PEI y Li+-PES
Polímero, 2001, 42(9):4367.
[30] SUN B, MINDEMARK J, EDSTRÃM K, et otros
A base de policarbonato Electrolitos de polímero sólido para baterías de iones de litio
Iónicos de estado sólido, 2014, 262: 738.
[31] SILVA M M, BARROS S C, SMITH M J, et al.
Caracterización de Electrolitos poliméricos sólidos a base de poli(carbonato de trimetileno) y litio. tetrafluoroborato
Electrochimica Acta, 2004, 49(12): 1887.
[32] BARBOSA P, RODRIGUES L, SILVA M Metal.
Caracterización de pTMCnLiPF6 electrolitos de polímero sólido
Iónicos de estado sólido, 2011, 193(1):39.